养殖中华鲟的产后康复
养殖中华鲟的产后康复
张晓雁1, 2杜 浩1危起伟1张艳珍2王彦鹏2蔡经江2刘志刚1乔新美1熊 伟1
(1. 中国水产科学研究院长江水产研究所, 农业部淡水生物多样性保护重点实验室, 武汉 430223; 2. 北京信沃达海洋科技有限公司(北京海洋馆), 北京 100081)
通过观测初次繁殖养殖中华鲟(Acipenser sinensis)亲本产后的摄食行为, 测量生长指标和监测血清中甲状腺指标、血液理化指标, 进行产后亲本11个月康复的效果分析。结果表明: 使用多春鱼(Mallotus villosus)可诱导产后亲本开口摄食及转食营养丰富的混合鲜饵。雌性产后身体虚弱, 摄食时行为异常, 随摄入营养水平逐渐提高, 雌性和雄性最大摄食量于产后7个月时分别达到体质量的2.04%和1.60%, 7个月后恢复正常。随混合鲜饵摄食量提高, 亲本体质量从下降转而升高(9个月间雌雄亲本增长率分别为44.16%和23.30%), 体长增长(增长率分别为5.00%和3.23%), 与同龄未产的养殖中华鲟(参照组)相比, 体质量和体长的增长率均处于较高水平。产后亲本血清总T3(TT3)、血清总T4(TT4)、血清游离T3(FT3)、血清游离T4(FT4)和多项血液理化指标在恢复培养期明显升高, 至培养期末, TT3 、FT3高于参照组, 其余指标多接近参照组平均水平, 表明产后亲本生理情况基本恢复。研究表明, 加强产后康复培养, 可以提高初次繁殖亲本, 尤其是雌性的健康恢复和生长效果, 对养殖中华鲟资源的重复利用和再次成熟后生殖力的提高至关重要。
中华鲟; 产后; 摄食行为; 生长; 血清中甲状腺指标; 血液生理指标; 血清生化指标
中华鲟(Acipenser sinensis)是国家一级保护动物。由于人类活动的干扰, 自然繁殖群体数量急剧减少, 自然种群灭绝的危险提高[1]。开展全人工繁殖是实现人工保种的有效途径[2]。由于中华鲟体型大, 性成熟晚, 性周期时间长, 养殖过程风险大、成本高,养殖达到初次性成熟的子代个体不仅数量有限, 相比于长江野生雌性最小性成熟个体, 其体质量和怀卵量亦明显减小[2, 3]。另外, 就野生产后个体而言, 经历长距离繁殖洄游期间不摄食, 繁殖后体质虚弱, 易引起死亡, 通过人工干预法可克服恢复摄食的障碍,获得康复及性腺再次发育[4, 5]。对于养殖中华鲟亲本,与野生相比, 没有产卵洄游前的育肥阶段, 性腺发育期间多停食, 产后恢复困难[2, 6]。因此, 进行养殖亲本产后康复和生长研究, 是促进产后亲本成活率和再次成熟后生殖力提高的关键, 为开展养殖中华鲟资源的重复利用提供支撑。同时, 通过产后亲鱼培育效果分析, 为产前亲鱼培育技术提供借鉴。
本研究通过对养殖产后亲本的摄食行为进行观察、测量生长指标及监测血清中甲状腺指标和血液理化指标, 通过与同龄性腺未成熟的养殖个体(参照组)比较, 以确定养殖亲本恢复效果, 为建立养殖亲本产后恢复培养技术提供指导。本研究对中华鲟物种保护具有现实意义。
1 材料与方法
1.1 养殖设施和养殖时间
本文产后恢复培养从2012年11月至次年9月止, 共计11个月。在临时养殖池(养殖池的池体规格32.0 m×12.0 m×3.8 m, 水温19.0—19.5 , ℃ 溶氧6.0—8.4 mg/L, 流速 0.2—0.5 m/s)培养前 2个月, 于12 月 28日转入驯养池(驯养池的池体规格 29.0 m× 11.0 m×4.4 m, 展示观察窗规格20.0 m×3.0 m, 水温21.0—22.5 , ℃ 溶氧7.0—7.8 mg/L, 循环水过滤系统的循环率为50 min/次, 养殖密度2.2 kg/m3)继续产后恢复培养9个月。
1.2 养殖亲本和饲养管理
雌、雄产后亲本[2](编号F51、F38)分别为长江水产研究所2001年和1998年秋季通过野生中华鲟人工繁殖的养殖个体, 于2012年10月28—30日实施人工催产, 繁殖前、后即刻测得的体长分别为180、180 cm和186、186 cm; 体质量分别为57、51 kg和64、58 kg。
在同一养殖条件下, 接近性成熟年龄的未产个体(12龄养殖个体), 血清Mg2+、TP、GLB、ALP和Ht值(本文检测的血液生理、生化指标)略低于处于性腺发育间隔期的野生成熟个体[7]。本文为分析产后亲本的恢复情况, 在驯养池内随机选取健康的雌雄鱼各4尾(同为长江水产研究所人工繁殖个体, 分别与雌雄亲本同龄, 处于性腺慢速发育阶段)作为参照组, 12月体长分别为(206±6)和(189±4) cm, 体质量为(89±9)和(72±4) kg。
产后亲本采用直接投洒冰鲜多春鱼(Mallotus villosus)的方式诱导开口。在转入驯养池后, 由潜水员水下采用多春鱼携带方式驯化投喂混合饵料, 逐渐增加混合饵料量, 直至完全摄食。每次投喂量以自主摄食量为主, 隔日喂食。同期, 参照组采用混合饵料由潜水员水下投喂, 平均投饵率为体质量的0.91%。将一定比例的冰鲜多春鱼、蓝点马鲛(Scomberomorus niphonius)、中国枪乌贼(Loligo chinensis)、南美白对虾(Penaeus vanname)绞碎, 添加适量维生素和螺旋藻, 搅拌均匀后黏合成混合鲜饵, 多春鱼和混合饵料的营养成分见表1。
1.3 摄食行为与生长和生理观察
摄食行为观察项目包括: 潜水员潜入水底喂食前后产后亲本的游泳区域、游泳水层、游泳平稳性,摄食积极性, 吞咽饵料行为过程, 摄食量等。各项目的计算方法如下:
游泳区域: 亲本在观察时段内经常游动的区域。区域划分方法为, 将驯养池按照长度平均分成6个区域, 约5 m/区, 顺序记为1—6, 3—4为中华鲟的日常水下投食区; 从池底向池水表面垂直分为 4个水层, 1.1 m/层, 从水体底部向表面顺序记为底层、下层、中层、上层(接近水体表面记为表层)。在池内外设置区域和水层划分记号。
游泳平稳性: 通过观察亲本游动时躯体左右摇摆程度及上浮和下潜的平稳性确定。平稳性好—游动时身体平稳, 可自如下潜或上浮; 平稳性较好—游动时身体左右摆动, 但不明显, 可自如下潜或上浮; 平稳性较差—游动时身体左右摆动较明显, 下潜或上浮时不仅尾部摆动幅度明显加大, 身体左右摆动较明显; 平稳性差—游动时身体左右摆动明显,下潜或上浮时尾部摆动幅度大, 且下潜或上浮困难。
摄食积极性: 通过观察潜水员投递饵料时亲本口的伸展程度表示。强—口完全伸展, 伸展长度≥10 cm; 较强—口伸展长度约为5—10 cm; 较弱—口伸展长度≤5 cm; 弱—口不主动伸展。
吞咽饵料过程: 观察描述行为表现和每次喂食时亲本吞吐和吞咽饵料的平均用时。
摄食量: 记录每次所摄食种类和摄食量。
为降低捕捞对产后亲本的影响, 从转入驯养池开始, 每 3个月捕捞测定生长参数和血液参数。尾静脉采血 5 mL, 血细胞参数的测定用肝素钠抗凝,其余参数测定用 3000 r/min离心 20min 后取血清, –4℃保存备用。各项血液参数的测定方法如下:
红细胞计数(Red blood sell, RBC): 以浓度为0.5% NaCl溶液为稀释液将血样稀释 200倍后, 用Neubarner氏计数板在显微镜下计数。
血红蛋白量(Hemoglobin, Hb): 采用比色法测定。
红细胞比积(Hematocritvalue, Ht): 采用温氏法测定。
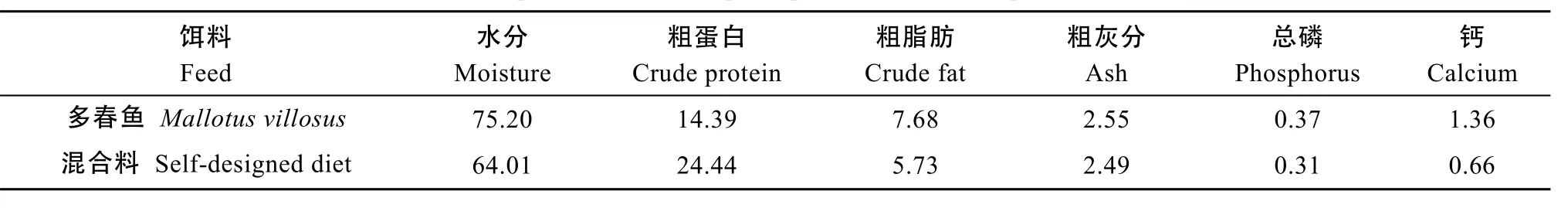
表1 产后亲本饵料的营养成分Tab. 1 The composition of feed of post-spawned cultured Acipenser sinensis (%)
实验测定的19项血清指标包括: 血清促甲状腺激素(Serum thyroid-stimulating hormone, TSH)、血清总T3 (Serum T3, TT3)、血清总T4 (Serum T4, TT4)、血清游离 T3 (Serum free T3, FT3)、血清游离 T4 (Serum free T4, FT4)、钙(Calcium, Ca2+)、无机磷(Phosphorus, P3+)、镁(Magnesium, Mg2+)、丙氨酸氨基转移酶(Glutamate-pyruvate, ALT)、天冬氨酸氨基转移酶(Aspartate aminotransferase, AST)、碱性磷酸酶 (Alkaline phosphatase, ALP)、 胆 碱 酯 酶(Cholinesterase, CHE)、总蛋白(Total protein, TP)、白蛋白(Albumin, ALB)、球蛋白(Globulin, GLB)、甘油三酯(Triglycerides, TG)、胆固醇(Total cholestero, CHO)、血糖(Glucose, GLU)。使用英科新创(厦门)科技有限公司生产的试剂盒在全自动生化分析仪(OLYMPUS AU400)上测定生化指标, 使用西门子生产的试剂盒在全自动化学发光免疫分析仪(ADVIA Centaur CP)上测定激素指标。
1.4 数据处理与计算公式
体长生长率: (Growth rate of length, GRL): GRL=(l2-l1)/l1
体重生长率: (Growth rate of weight, GRW): GRW=(W2-W1)/W1
式中, l1、l2为单位时间内始、末体长(cm); W1、W2为单位时间内始、末体重(kg)。
参照组数据统计分析用SPSS 13.0软件完成。用单因素方差分析(ANOVA)参照组血液指标差异, 以P<0.05为显著水平。参照组结果为平均值±标准差。
2 结果
2.1 摄食行为和摄食量
在人工催产繁殖后, 采用产前培育期的主要饵料多春鱼诱导开口, 产后亲本 2周后摄食, 每日仅食少量多春鱼, 摄食过程中反复吞吐饵料, 并从鳃孔溢出大量饵料碎渣。在转入驯养池后(12月28日),潜水员通过多春鱼携带混合饵料方式伴随游动, 驯化喂食(携带量逐渐增加), 20d后产后亲本可直接摄食混合料, 摄食量逐步提高, 摄食过程中吞吐饵料及从鳃孔溢出饵料碎渣行为逐渐减少。雌性亲本从4月开始, 摄食期间降至池体下层进入喂食区域寻食, 摄食积极性和摄食量明显提高, 游泳平稳性逐渐转好, 于 5月可直接吞咽饵料。雄性摄食行为恢复快于雌性, 于4月可直接吞咽饵料(表2)。雌性恢复培养初期摄食期间行为明显异常, 主要表现为随吞吐饵料时鳃孔溢出大量气泡, 身体明显下沉, 然后冲出水面吸气调节身体平衡。随着4月后摄食量持续提高, 此行为明显减轻至消失。培养后期雌性摄食量增高幅度明显大于雄性亲本。从转入驯养池至培育期末, 摄食量占体质量比例为雌性 0.52%—2.04%, 雄性0.39%—1.60%。
2.2 生长效果
雌雄亲本的体长和体质量产后培育期间变化趋势相似(图 1), 至培育期末, 体长分别为 189和192 cm, 体质量为55.5和63.5 kg。从转入驯养池到培育期末, 体长增长率分别为5.00%和3.23%, 体质量增长率分别为 44.16%和 23.30%。雌、雄参照组在培育期体长和体质量的增长率分别为 2.91%、2.65%和15.73%、5.56%, 明显低于产后雌雄亲本。2.3 血清中甲状腺指标和血液理、化指标的变化
雌性亲本多项血液指标培育初期低于参照组平均水平, 经产后培育, 15项指标可恢复, 其中6项指标, Ca2+、P3+、AST、CHE、GLU、RBC在较短时间(产后5个月左右)可恢复, 9项指标TT4、FT4、ALP、TP、ALB、GLB、CHO、TG、Hb产后较长时间(产后8—11个月左右)恢复至参照组平均水平。

表2 产后亲本在驯养池的摄食行为Tab. 2 The feeding behaviour of post-spawned cultured Acipenser sinensis during the recovering in the aquarium

图1 产后培育期间亲本体长和体质量的变化Fig. 1 Changes in the body length and the body weight of postspawned cultured Acipenser sinensis during the recovering
4项指标培育期末未恢复, TT3、FT3、ALT高于参照组平均值, TT3、FT3近 3倍于参照组平均水平, ALT约1.7倍于参照组平均水平, Ht低于参照组平均值。TSH、Mg、A/G培育期间无明显变化, 接近参照组平均水平(表3)。雄性亲本产后培育期间血液指标恢复与雌性亲本有所不同(表 4)。12项指标可恢复, Ca2+、AST、GLB、RBC 4项指标在较短时间可恢复, FT4、TT4、TP、ALB、A/G、CHO、Ht、Hb 8项指标产后较长时间恢复, TT3、FT3变化趋势与雌性亲本较相似, 约2倍于参照组平均值, ALP低于参照组平均值。TSH、Mg2+、P3、ALT、CHE、GLU、TG 7项指标培育初期接近参照组平均水平, 以后变化不明显。与雌性亲本相比, 雄性亲本培育初期多项指标稳定, GLB值升高速度快于雌性, 至培育期末, 多数指标值恢复。这表明至培育期末, 产后亲本生理情况基本恢复, 雄性亲本在初期恢复效果优于雌性亲本。
3 讨论
3.1 人工条件下可实现养殖中华鲟产后康复和继续生长
本文产后养殖亲本为长江水产研究所 2012年初次全人工繁殖的个体, 产后身体虚弱, 通过本次康复培养实验, 逐渐恢复摄食, 甲状腺激素分泌水平提高, 血液理化指标值趋向于同龄未产组平均水平, 生长优于未产组, 雌性异常行为恢复正常, 说明产后养殖亲本可以获得康复并继续生长, 这也使得中华鲟养殖亲本再次成熟后生殖力的提高成为可能, 对养殖中华鲟资源的重复利用具有重要意义。
3.2 养殖中华鲟产后的摄食行为
在鱼类繁殖后, 恢复摄食的效果和摄入的营养水平是影响亲本成活率及再次繁殖周期长短的主要因素[8]。在天然水域中, 产后中华鲟食物可获得性受到环境限制, 存活率低, 再次繁殖的间隔时间是2年甚至更长时间[9]; 而蓄养产后野生中华鲟可摄食营养丰富的食物, 存活率高, 产后7—12个月行为恢复,再次发育的间隔时间多为2—3年[5]。在本研究中, 产后亲本摄食欲差, 特别是雌性身体虚弱, 提供营养丰富的适口性饲料并促进其快速摄食是康复成功的关键。雌性亲本产后初期摄食期间泳层与游泳区域不固定, 不能直接游至下层寻食, 且游动平稳性差,通过潜水员伴随游动投递食物方式, 提高了食物的可获得性, 降低摄食时的体能消耗。随体力逐渐加强, 摄食积极性增强, 摄食期间可降低泳层主动寻食, 摄食量也逐步提高。中华鲟对食物有较长时间记忆[5], 摄取食物后, 主要靠口腔触觉和味觉判断适口性, 最终吞入或摒弃食物, 对部分食物的选择性可以被逐步驯化[4, 10]。在本文中, 先采用产前主要食物多春鱼诱导产后亲本开口, 然后混合以多春鱼为原料的自制鲜饵继续驯化, 利于亲本快速选食[11]。由于雄性亲本产前即摄食混合饵料, 因此适应混合料的时间明显短于雌性。相较于野生产后中华鲟通过灌食促进恢复摄食而言, 养殖中华鲟较容易恢复摄食, 但采用多春鱼驯化摄食混和饵料也需要20d[4],与野生中华鲟灌食到自主摄食的时间相似, 这可能与中华鲟消化有关的酶类及消化有关的神经内分泌系统需要一段时间平衡有关[8]。另外, 野生中华鲟主动摄食后泳层即下降, 雌性亲本则远长于野生, 可能受其虚弱体质影响所致[4, 5]。混和饵料的营养均衡性优于多春鱼, 利于促进产后亲本快速康复。
行为是动物对外界环境和内部环境变化的外在反应。本文雌性亲本产后初期摄食行为明显异常。分析认为, 一方面, 养殖个体类似于天然水域野生个体, 在性腺发育过程中停食或少食, 依靠体内的脂肪完成性腺的最后成熟[9], 但是由于缺少野生中华鲟繁殖洄游前的育肥阶段, 性腺发育过程又要消耗大量营养物质(特别是雌性), 致使产后体内营养物质积累不足, 易导致体质虚弱。其次, 大型雌性动
物一般在人工繁殖过程中受到的损伤和应激大于雄性, 这也容易导致产后胃肠神经紊乱和虚弱, 致厌食甚至死亡等[12]。中华鲟靠气鳔保持浮力, 气鳔开口于食道后段, 健康个体可以将吞入的空气通过鳔管送入鳔内, 也可以通过气鳔周围肌肉的收缩经鳔管把空气排出以调节浮力[13]。雌性亲本产后体弱,可能胃肠神经紊乱, 吞吐饵料时食道和气鳔周围肌肉不能协调运动, 摄食时浮力控制出现异常。随摄食逐渐恢复, 摄入营养量提高, 雌性亲本产后7个月体力明显增强, 行为恢复正常, 与蓄养野生产后中华鲟行为恢复正常的时间相似[5]。这说明, 在人工养殖条件下, 营养丰富的适口饵料和促进摄食的方法可以提高养殖亲本(特别是雌性)的产后恢复效果,这也是本文研究获得成功的关键。本文混合饵料仅是初步尝试, 深入探讨亲本在性腺进入快速发育阶段前的营养强化方式, 研究产后恢复培养时具有诱食效果的强化饵料, 可以成为中华鲟亲鱼培育技术新的研究方向。

表3 雌性亲本产后培育期间血液指标与参照组比较Tab. 3 Comparison of the blood indices between the post-spawned female and the referenced female during recovery (n=4)

表4 雄性亲本产后培育期间血液指标与参照组比较Tab. 4 Comparison of the blood indices between the post-spawned male and the referenced male during recovery (n=4)
3.3 初次繁殖的养殖中华鲟产后生长特点
危起伟等[2]研究了初次性成熟的养殖中华鲟生物学情况, 发现雌性年龄小于记录到的最小野生雌性中华鲟性成熟年龄, 性成熟体长和体质量值远小于长江野生雌性最小成熟个体值, 认为这不利于中华鲟的保护和规模化培育。本文亲本出现产后体长继续生长的特点, 与天然水域产后亲本可持续生长的特点相同[9]。养殖亲本生长速度均优于未进入性腺快速发育的同龄未产组, 这可能是长期饥饿后摄入丰富的食物时出现的补偿生长现象[13]。另外, 水深、空阔、水质清新的大型养殖空间有利于大体型成体中华鲟的生长[14]。这说明, 在人工条件下, 通过加强产后培养, 可以提高亲本的生长率, 这使得初次繁殖亲本个体小的情况得以改善成为可能, 对于提高再次成熟后的生殖力具有现实意义。
3.4 产后亲本的血清甲状腺指标、血液理化指标与摄食、健康情况及生长性能的关系
鱼类的甲状腺素主要是T3 和T4 [T3是由T4在外周组织中(主要是肝脏)脱碘转化而来的], 对代谢活动、生长、行为等有重要作用, T3的生物活性比 T4强[15]。饥饿会影响下丘脑—垂体—甲状腺轴,使甲状腺对TSH刺激的敏感性降低, T4向T3的转化率下降[16]。在本文培养期间, 产后亲本TSH持平于参照组, 而食物摄取量提高后甲状腺激素水平明显升高, 表明食物摄取量对甲状腺激素的分泌影响较大。这与对黑鲷(Sparus macroehhalus)、虹鳟(Oncorhynchus mykiss)等研究结果较为一致[17]。食物的营养成分(特别是蛋白质)是影响甲状腺激素分泌的重要因子[18], 本文产后培养采用的主要饲料中蛋白质含量较高, 可能也更有利于促进甲状腺激素的产生。雄性亲本产后初期TT3、FT3、TT4水平和体质量增长率大于雌性, 而6月以后, 雌性TT3、FT3水平和体质量增长率明显高于雄性。另外, 相比于参照组, 雌、雄产后亲本实验末期 TT3、FT3和雌性体长、体质量及雄性体长均处于较高水平, 说明了甲状腺激素与生长关系密切。这在其他鱼的生长研究中也有类似报道[17, 18]。
RBC与Ht培养期间快速增高, Hb升高速度滞后于红细胞增生的速度。鱼类红细胞由脾脏等造血器官产生, 主要有携带和运输氧气及排除二氧化碳的功能。随摄食逐渐恢复, 红细胞快速增生, 说明红细胞生成过程受营养水平影响大, RBC值增高显示机体代谢活动增强。
产后亲本Ca2+、Mg2+、P3+3月恢复至参照组平均水平。Ca2+、P3+在骨骼形成和维持酸碱平衡等代谢中起重要作用, Mg2+除了参与骨盐形成外, 还是很多酶的激活剂。3种离子含量快速恢复, 表明随着恢复摄食, 产后亲本可通过自身的调节快速维持内环境的稳定。较雄性亲本相比, 雌性的 Ca2+及钙磷比值在12月时均明显低于参照组水平, 这可能受到卵巢发育过程中卵黄蛋白原合成的影响所致[19]。
ALT主要存在于肝细胞胞浆中, 肝细胞受损,细胞通透性增强, 血清ALT活性上升。AST也存在于肝脏, 也可反映肝脏的生理状态。CHE主要由肝脏合成, 故能灵敏地评价肝细胞的合成能力, 与ALT、AST可做为指示肝脏功能的酶学指标[20, 21]。本文产后亲本3月时ALT、AST、CHE接近参照组平均水平, 说明肝脏的的代谢活动已接近健康的未产个体。培育末期, 雌性产后亲本ALT增高至参照组1.7倍的水平, 这主要与其后期快速生长, 甲状腺功能亢进有关[22]。ALP主要来源于肝脏、肾脏、成骨细胞等脏器和组织, 是反映成骨细胞活性、骨生成状况和钙、磷代谢及肾脏功能的重要生化指标,甲状腺激素影响ALP活性[22, 23]。雌性亲本培育末期ALP快速升高, 与甲状腺激素分泌水平和继续加速生长趋势一致。另外, ALP值接近参照组平均水平也说明肾脏功能逐渐恢复。雄性ALP在恢复培养期间较稳定, 至培育末期略有提高, 仍然低于参照组平均水平。这与其体长增长6月后才快于参照组较为一致。
GLU是机体组织生化活动所需能量的来源, CHO、TG是脂肪的代谢产物, 与TP同受营养水平的影响显著[24, 25]。产后亲本 TP、ALB、GLB值随摄食量提高持续增高, 表明受营养水平影响明显,与对施氏鲟(Acipenser schrenckii)[26]的研究结果较为一致。鱼的生长主要是依靠蛋白质在体内构成组织和器官, 摄入蛋白质总量提高后, 机体蛋白质代谢增强, 合成速率提高, 因此TP、ALB、GLB与体质量表现出一致的增长趋势, 这也说明TP、ALB、GLB能较好地反映机体的营养水平。雌性亲本TP、ALB、GLB值 12月远低于参照组, TG、CHO、GLU也有类似表现, 而雄性相对差别较小, 表明雌性性腺发育和繁殖过程消耗的营养和能量物质多, 易造成产后体内营养积累不足, 导致体质虚弱。这也提示,加强产后营养护理是促进雌性亲本康复的关键。
综上所述, 本次养殖亲本产后康复培养初次获得成功, 尽管亲本获得较好的康复和生长效果, 然而由于本研究主要依据 2012年全人工繁殖的产后亲鱼恢复培养实验数据得来, 受研究样本量限制,尚存在偶然因素影响, 产后初期数据完整性也存在不足, 还需继续增加实验样本, 积累多批次恢复培养数据。
[1] Wang J H, Wei Q W, Zou Y C. Conservation strategies for the Chinese sturgeon, Acipenser sinensis, an overview on 30 years of practices and future needs [J]. Journal of Applied Ichthyology, 2011, 27(2): 176—180
[2] Wei Q W, Li L X, Du H, et al. Research on technology for controlled propagation of cultured Chinese sturgeon (Acipenser sinensis) [J]. Journal of Fishery Science of China, 2013, 20(1): 1—11 [危起伟, 李罗新, 杜浩, 等. 中华鲟全人工繁殖技术研究. 中国水产科学, 2013, 20(1): 1—11]
[3] Webb M A, Doroshov S I. Importance of environmental endocrinology in fisheries management and aquaculture of sturgeons [J]. General and Comparative Endocrinology, 2011, 170(2): 313—321
[4] Zhang X Y, Liu J Y, Wei Q W, et al. Recovery of foraging ability of wild female Chinese sturgeon after artificial propagation in aquarium by different feeding methods [J]. Chinese Journal of Zoology, 2007, 42(2): 142—146 [张晓雁,刘鉴毅, 危起伟, 等. 不同喂食方法对野生产后中华鲟的摄食促进. 动物学杂志, 2007, 42(2): 142—146]
[5] Wei Q W, Zhang X Y, Zhang X F, et al. Acclimating and maintaining Chinese sturgeon Acipenser sinensis in a large public aquarium environment [J]. Journal of Applied Ichthyology, 2011, 27(2): 533—540
[6] Guo B F, Chang J B, Xiao H, et al. The productive biology of first filial generation of Acipenser sinensis growing up in the freshwater environment [J]. Acta Hydrobiologica Sinica, 2011, 35(6): 940—945 [郭柏福, 常剑波, 肖慧, 等. 中华鲟初次全人工繁殖的特性研究. 水生生物学报, 2011, 35(6): 940—945]
[7] Zhang X Y. Blood biochemistry and its applications in Chinese sturgeon (Acipenser sinensis) [D]. Thesis for Master of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2012 [张晓雁. 中华鲟血液生化学的研究与应用. 博士学位论文, 中国科学院水生生物研究所,武汉. 2012]
[8] Liu L, Zhang J M, Guo F, et al. Effects of renewal cultivation and renewal reproduction after spawning in Japanese eel Anguilla japonica [J]. Journal of Fishery Science of China, 2004, 11(1): 54—58 [柳凌, 张洁明, 郭峰, 等. 日本鳗鲡人工催产后亲鱼恢复培养与再催产效果. 中国水产科学, 2004, 11(1): 54—58]
[9] Chen X H. Biology and Resources Status of Acipenseriformes [M]. Beijing: Ocean Press. 2007, 96—99 [陈细华.鲟形目鱼类生物学与资源现状. 北京: 海洋出版社. 2007, 96—99]
[10] Zhuang P, Zhang L Z, Luo G, et al. Function of sense organs to the feeding behavior of juveniles Chinese sturgeon captured from the Yangtze estuary [J]. Acta Hydrobiologica Sinica, 2008, 32(4): 475—481 [庄平, 章龙珍, 罗刚, 等.长江口中华鲟幼鱼感觉器官在摄食行为中的作用. 水生生物学报, 2008, 32(4): 475—481]
[11] Kasumyan A Q. Sturgeon food searching behaviour evoked by chemical stimuli: a reliable sensory mechanism [J]. Journal of Applied Ichthyology, 2002, 18(4—6): 685—690
[12] Yu Y Q. Prevention methods of anorexia in postpartum sows [J]. Shandong Journal of Animal Science and Veterinary Medicine, 2012, 33(22): 34—35 [于彦强. 母猪产后不食症的综合防治方法. 山东畜牧兽医, 2012, 33(22): 34—35]
[13] Xie C X. Ichthyology [M]. Beijing: China Agriculture Press. 2010, 304 [谢从新. 鱼类学. 北京: 中国农业出版社. 2010, 304]
[14] Yang D G, Wei Q W, Wang K, et al. Three types of culture Chinese sturgeon (Acipenser sinensis) and analysis of their effects by comparison [J]. South China Fisheries Sciences, 2006, 2(2): 1—5 [杨德国, 危起伟, 王凯, 等. 淡水养殖中华鲟成鱼的三种方式及效果比较. 南方水产, 2006, 2(2): 1—5]
[15] Lin H R. Fish Physiology [M]. Guangzhou: Guangzhou Higher Education Press. 2004, 222 [林浩然. 鱼类生理学.广州: 广州高等教育出版社. 2004, 222]
[16] Pedro N D, Delgado M J, Gancedo B, et al. Changes in glucose, glycogen, thyroid activity and hypothalamic catecholamines in tench by starvation and refeeding [J]. Journal of Comparative Physiology B, 2003, 173(6): 475—481
[17] Deng L, Zhang W M, Lin H R. Effects of starvation on the contents of growth hormone and triiodothyronine in serum, and lipid and protein of white muscles and livers in black seabream [J]. Zoological Research, 2003, 24(2): 94—98 [邓利, 张为民, 林浩然. 饥饿对黑鲷血清生长激素、甲状腺激素以及白肌和肝脏脂肪、蛋白质含量的影响. 动物学研究, 2003, 24(2): 94—98]
[18] Wang G Q, Zhou G Q, Chen J M, et al. Effect of dietary protein on growth and hormone of cultural burnus juveniles [J]. Acta Hydrobiologica Sinica, 2008, 32(4): 543—550 [王桂芹,周洪琪, 陈建明, 等. 鲌饲料蛋白对翘嘴红 生长和内分泌激素的影响. 水生生物学报, 2008, 32(4): 543—550]
[19] Matsche M A, Rosemary K M, Brundage H M. Hematology and plasma chemistry of wild shortnose sturgeon Acipenser brevirostrum from Delawarw River, USA [J]. Journal of Applied Ichthyology, 2013, 29(1): 6—14
[20] Zhong Q J, Zhang S F. The Analysis Technique of Biochemistry [M]. Wuhan: Huazhong University of Science and Technology Press. 2012, 196—200 [仲其军, 张淑芳.有机化学检验技术. 武汉: 华中科技大学出版社. 2012, 196—200]
[21] Wang Z D, Yang J J, Li L A, et al. Effects of different intensities of swimming stress on serum ALT, AST and AIP activities in mice [J]. Heilongjiang Animal Science and Veterinary Medicine, 2013, (11): 164—166 [王转丁, 杨晶晶, 李留安, 等. 不同强度游泳应激对小鼠血清 ALT、AST和 ALP活性的影响. 黑龙江畜牧兽医, 2013, (11): 164—166]
[22] Su H X, Zhong Y H, Gao B H. Detection and clinical value of liver function for the patients with hyperthyroidism [J]. Journal of Guangxi Medical University, 2002, 22(1): 91—92[苏会璇, 钟宇华, 高碧华. 甲状腺功能亢进症者肝功能的检测及其临床意义. 广西医科大学学报, 2002, 22(1): 91—92]
[23] Wang S Y, Yan S M. Research progress of alkaline phosphatase in bone metabolism of animal [J]. Feed Review, 2009, (4): 14—16 [王石莹, 闫素梅. 碱性磷酸酶在动物骨骼代谢中的研究进展. 饲料博览, 2009, (4): 14—16]
[24] Qiang J, Yang H, Wang H, et al. Effects of different dietary protein levels on serum biochemical indices and expression of liver HSP70 mRNA in gift tilapia (Oreochromis niloticus) under low temperature stress [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 434—443 [强俊, 杨弘, 王辉, 等. 饲料蛋白水平对低温应激下吉富罗非鱼血清生化指标和HSP70 mRNA表达的影响. 水生生物学报, 2013, 37(3): 434—443]
[25] De Pedro N, Guijarro A I, Lpez-patio M A, et al. Daily and seasonal variations in hematological and blood biochemical parameters in the tench, Tinva tinca Linnaeus, 1758 [J]. Aquaculture Research, 2005, 36(12): 1185—1196
[26] Zhang L Z, Zhuang P, Zhang T, et al. Hematological biochemical norm of different age groups of cultured Amur sturgeon (Acipenser schrenckii) [J]. Journal of Fisheries of China, 2007, 31(2): 159—164 [章龙珍, 庄平, 张涛, 等. 人工养殖不同年龄施氏鲟的血液生化指标. 水产学报, 2007, 31(2): 159—164]
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

