论文:青鱼鳍条组织细胞系的建立及其生物学特性
青鱼鳍条组织细胞系的建立及其生物学特性
张雪萍1,2,曾令兵2,陈倩1,周勇2,3,张琳琳1
(1.华中农业大学水产学院,武汉430070;
2.中国水产科学研究院长江水产研究所,武汉430223;
3.湖州师范学院浙江省水生生物资源养护与开发技术研究重点实验室,浙江湖州313000)
摘要:采用组织块移植培养技术,对来源于青鱼(Mylopharyngodon piceus)的鳍条组织细胞进行原代培养,建立了青鱼鳍条组织细胞系,定名为BC-Fin。青鱼鳍条组织细胞为成纤维样细胞,已稳定传代培养50多代,其最适培养温度为25 ℃,最佳培养基为L-15,最适血清浓度为15%,在最适培养条件下,青鱼鳍条组织细胞的群体倍增时间为60.6 h。青鱼鳍条组织细胞液氮冷冻保藏6个月后,经台盼蓝染色,约(90.09±4.65)%的细胞具有细胞活性,复苏后的细胞生长旺盛。细胞染色体分析显示,第16代青鱼鳍条组织细胞的染色体数目为正常二倍体(2n=48),第41代细胞染色体众数为46。通过对离体培养细胞的线粒体中的16S rRNA基因进行特异性扩增,获得长度为320 bp的核酸片段,核酸序列比对分析结果表明,其与青鱼16S rRNA基因序列的一致性达98%,表明该细胞来源于青鱼。病毒敏感性试验结果显示,在感染草鱼呼肠孤病毒(GCRV)后BC-Fin细胞系可产生典型细胞病变效应,病毒滴度为10(5.33±0.21) TCID(50)/mL,且PCR检测可检测出细胞培养的草鱼呼肠孤病毒,表明BC-Fin细胞系对草鱼呼肠孤病毒较敏感。
关键词:青鱼(Mylopharyngodon piceus);鳍条组织;细胞系;生物学特性;病毒敏感性
青鱼(Mylopharyngodonpiceus),隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)青鱼属(Mylopharyngodon)。由于味道鲜美,营养价值高,备受养殖者和消费者青睐。随着青鱼养殖业的发展,病害问题日趋严重,其中,青鱼出血病在湖北、江苏、浙江及上海等地危害严重[1]。翟子玉[2]等对青鱼出血病作了较为系统的研究,并且分离出导致出血病的病毒,制备了组织灭活疫苗,开展了青鱼出血病免疫预防试验。但是,长期以来,来源于青鱼的细胞资源缺乏,制约了青鱼出血病等病毒性疾病诊断与防治技术研究的开展。本研究建立了青鱼鳍条的细胞系,对其生物学特性与病毒敏感性进行了较为系统的研究,不仅丰富了鱼类细胞资源,而且为今后开展病毒病流行病学特征、致病机理、诊断技术以及防控技术研究提供了重要的实验材料。
1材料和方法
1.1材料
1.1.1试验鱼与病毒株
健康青鱼,体重约50 g,来自于长江水产研究所窑湾基地。实验前在实验室暂养2周。草鱼呼肠孤病毒JX-0901株由中国水产科学研究院珠江水产研究所吴淑勤研究员惠赠。
1.1.2试剂与耗材
L-15、R-1640、MEM、M199 培养液、两性霉素B、青霉素/链霉素、磷酸缓冲液(DPBS)、胰蛋白酶-EDTA (Typsin- EDTA)、4-羟乙基哌嗪乙磺酸(HEPES)、二甲基亚砜(DMSO)、秋水仙素, 以上均购自sigma公司;胎牛血清(FBS)为杭州四季青生物工程材料公司产品;生长因子bFGF和EGF购自普飞生物;相关分子试剂均购自TaKaRa。 25 cm2和75 cm2细胞培养瓶,15 mL和 50 mL离心管,规格为1、2、5 和10 mL的移液管,1.8 mL的冻存管均为自Corning公司产品;程序降温盒购自Nalgene公司。
1.1.3主要仪器设备
Ⅱ级生物安全柜(ESCO);倒置显微镜(Nikon);正置显微镜(OLYMPUS),照相 CCD(OLYMPUS);低速冷冻离心机(Sigma);恒温培养箱 (Sanyo);制冰机(Gelin);液氮罐(MVE)。
1.2方法
1.2.1原代培养
将健康青鱼浸于20 mg/L的高锰酸钾溶液中消毒30 min,再用70%酒精擦拭鱼体体表,置鱼体于II级生物安全柜内,取其鳍条组织。参照薛庆善[3]和Freshney[4]的原代培养法,采用组织块移植法进行原代细胞培养。将鳍条剪成约1 cm3的组织块,先用含高浓度双抗的DPBS 缓冲液(500 U/mL青霉素、500 μg/mL链霉素、12.5 μg/mL两性霉素B)清洗3次,再用含高浓度双抗的培养液L-15(500 U/mL青霉素、500 μg/mL链霉素、12.5 μg/mL两性霉素B)清洗1次,然后将组织块移植到规格为25 cm2的细胞培养瓶中(Corning,USA),均匀平铺于培养瓶底面,倒置平放,贴壁2 h 后加1.5 mL含30%胎牛血清的L-15 培养液(含200 U/mL青霉素、200 μg/mL链霉素、5.0 μg/mL两性霉素B,25 ng/mL EGF 和25 ng/mL bFGF),置于25 ℃的培养箱培养,隔日加同样的培养液至3 mL。随后逐日观察生长状况,每3日更换一半培养液。倒置生物显微镜记录细胞生长情况。
1.2.2传代培养
当细胞从组织块中迁出单层达培养瓶底面积70%时,参照肖艺等[5]的方法进行细胞传代培养。用PBS 清洗细胞,用胰蛋白酶(1×)消化细胞,当细胞收缩变圆时,用含10%FBS的L-15中和胰蛋白酶,终止消化并吹打分散细胞,1 000 r/min离心5 min(Sigma,3K15),细胞沉淀用含有20%的DFBS新鲜培养液5 mL悬浮,转移至新培养瓶中25 ℃下继续培养。待传代培养细胞生长成单层,再采用上述相同方法进行分瓶扩大培养。
1.2.3细胞的冻存与复苏
青鱼鳍条细胞的冻存:细胞冷冻保存液由终浓度分别为10%二甲基亚砜(DMSO)、20%血清(FBS)、70% L-15 培养液组成[6]。操作前,预先制备含20%二甲基亚砜(DMSO)、40%胎牛血清、40% L-15培养液的冷冻保存液,置于冰上预冷待用;将用于细胞冷冻保存的程序降温盒(盛有异丙醇)于4 ℃冰箱过夜预冷备用;细胞冻存管置冰上预冷。用胰酶(1×)消化细胞,当细胞收缩变圆时,迅速用含 10% 血清的培养液终止消化,离心收集细胞(1 000 r/min,5 min),弃上清液,用不含血清的培养液悬浮细胞(与预先配制的细胞冷冻保存液等体积混合),缓慢加入冰上预冷的冷冻保存液中,用移液管缓慢混匀,再分装于冰上预冷的细胞冻存管中,每冻存管1.0~1.5 mL,最佳密度为1×106/mL,将细胞冻存管置于预冷的程序降温盒中,置-80 ℃冰箱过夜后再移入液氮灌中长期冻存。
青鱼鳍条细胞的复苏:液氮保存180 d后取出冷冻保存的BC-Fin细胞,37 ℃水浴迅速融化,将细胞移入培养瓶,添加 4~5 mL 含10%FBS的L-15培养液,于 25 ℃培养过夜,次日吸出所有培养液以除去DMSO,再添加新鲜培养液继续培养。从液氮中取出的细胞在37 ℃水浴融化后,取少许细胞用台盼蓝染色,显微镜下观测细胞活性。
1.2.4最佳培养基
选择4种培养液L-15、MEM、M199、R-1640,每种培养液配制成终浓度含15% FBS的细胞培养液。调整细胞密度为5×104/mL接种到12孔板,每孔1 mL,置于25 ℃培养箱培养。每隔2 d取2孔平行样,用胰酶(1×)消化后计数,连续取样6次,共计12 d,绘制其在不同培养液下的生长曲线。
1.2.5最适血清浓度
选择L-15培养液,分别配制终浓度为5%、10%、15%、20%FBS 的细胞培养液。调整细胞浓度为5×104/mL,接种到12孔板,每孔1 mL,正常培养。每隔2 d取2孔平行样,用胰酶(1×)消化后计数,连续取样6次并计数,共计12 d,绘制其在不同血清浓度下的生长曲线。
1.2.6最适培养温度
配制终浓度含15% FBS的L-15细胞培养液,设置15、20、25、30 ℃四个温度梯度,调整细胞密度依旧为5×104/mL,接种于12孔板,每孔1 mL,每个温度下培养一个12孔板的细胞,每2 d取2孔平行样,用胰酶(1×)消化后计数,连续取样6次,共计12 d,绘制其在不同温度下的生长曲线。
1.2.7 细胞群体倍增时间
取对数生长期的细胞,进行传代,所用的培养液是终浓度含15% FBS的L-15,以1×105/孔 的细胞浓度接种于6孔板,置于25 ℃细胞培养箱培养。每隔12 h取3孔平行样,用胰酶(1×)消化后计数,连续取12次,共计6 d。根据公式T=t×lg2/lg(Nt/N0)计算青鱼鳍条细胞的群体倍增时间;以培养时间(d)为横坐标,细胞浓度为纵坐标,绘制生长曲线。
1.2.8细胞染色体分析
取16代、41代的青鱼鳍条细胞,传代24 h后,弃原有培养液,接质量终浓度为1.0 μg/mL的秋水仙素,继续在原培养箱内培养13~15 h,用胰酶(1×)消化细胞、收集并离心,用DPBS清洗细胞,用冰醋酸和甲醇的混合液(体积比3∶1)预处理细胞,参照Wang等[6]的方法经过低渗、固定、制片、晾干、吉姆萨染色,制备染色体薄片,随机抽取100个样品,100倍油镜下观察染色体,统计其数目。
1.2.916S rRNA 分析
参照Wang等[6]的方法,从培养的青鱼鳍条细胞中提取总DNA。设计青鱼线粒体中16S rRNA 基因的特异性引物,其序列为: 16S-F (5′-ACCGAACCTGGTGATAGC-3′) 和 16S-R (5′-TTTC-TTCCATGTGGGCAT-3′)。 PCR扩增反应总体系25 μL,2.5 μL PCR 缓冲液(10×),2.0 μL dNTPs,2.0 μL MaCl2,2条引物各0.4 μL,0.2 μL Taq-DNA酶,1.0 μL DNA 模板,16.5 μL 水,混合后进行PCR扩增。PCR扩增反应条件为: 首先94 ℃预变性5 min;然后95 ℃ 1 min、55 ℃ 1 min、72 ℃ 1 min,30次循环;再72 ℃保温10 min;最后 4 ℃保温。将PCR扩增产物克隆到pMD-19T载体转化到DH5α中,检测到的阳性克隆进行扩增产物测序与比对分析。
1.2.10病毒敏感性
传代培养的青鱼鳍条细胞形成汇合单层后,弃培养液,加入1.0 mL GCRV细胞毒,病毒的感染复数MOI(multiplicity of infection)为1,加入终浓度为10 μg/mL polybrene,25 ℃吸附1.5 h,期间每间隔15-20 min轻微晃动培养瓶1次以便均匀吸附。吸附结束后,弃多余病毒液,添加5 mL含2%FBS 的L-15培养液,25 ℃培养,同时设置阴性空白对照。光学显微镜下逐日观察细胞病变效应。采用微量培养板(Corning)培养法测定病毒滴度,按照Reed-Muench法计算病毒滴度。待病毒感染的青鱼鳍条组织细胞出现典型细胞病变效应 (CPE) 达70%时,进行PCR检测。弃掉原有细胞培养液,用DPBS清洗3次,-80 ℃与室温反复冻融三次后,3 000 r/min,4 ℃离心30 min,收集沉淀,RNAzol 法提取病毒基因组RNA,逆转录合成cDNA。设计与合成草鱼呼肠孤病毒JX-0901株特异性引物P1:5′-TCTCTACCATCCGTTGGTTGTCC-3′和P2:5′-ATCGTTGTTGAGCTGAGCCTCTT-3′,进行PCR扩增,预期扩增产物大小为461 bp。
2结果
2.1原代培养
青鱼鳍条组织块接种到25 cm2细胞瓶后1~2 d可良好贴壁,3-4 d有些许细胞从组织块周围迁出,6 d左右可形成生长晕(图1), 9 d时迁出的细胞已形成单层(图2),15 d后单层细胞约占瓶底面积70%。
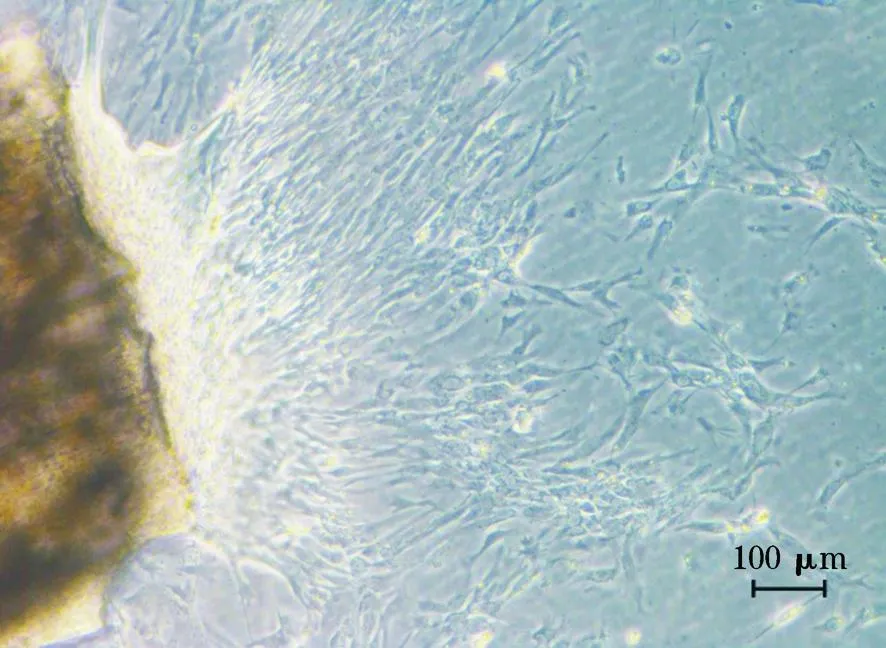
图1 原代培养第6天的BC-Fin细胞

图2 原代培养第9天的BC-Fin细胞
2.2传代培养
细胞首次传代,约8~12 h可贴壁生长,但较多细胞无法贴壁,形成单层细胞需要5 d左右。连续传代8次后,传代细胞12 h后90%可贴壁生长,贴壁数目明显增加,且3 d可形成单层细胞。目前青鱼鳍条细胞已传代50多次,细胞形态和生长稳定(图3)。

图3 传代培养的第40代BC-Fin细胞
2.3细胞的冻存与复苏
青鱼鳍条细胞在液氮中冻存6个月后复苏,用台盼蓝染色计数,经统计细胞成活率高达(90.09±4.65)%。复苏后的细胞经观察,形态上无明显差别,贴壁较快,生长状态良好,因此青鱼鳍条细胞可长期保存。
2.4最佳培养基
青鱼鳍条细胞在MEM、M199、R-1640、L-15四种培养液中均有生长,L-15更适合BC-Fin细胞生长。如图4所示,R-1640 在培养早期细胞生长较为迅速,但从4 d开始生长缓慢,6 d后细胞量开始下降;MEM和M199培养基中细胞生长较为缓慢,细胞数峰值仅为1.5×105/mL左右,且8 d后细胞数量出现下降;L-15 培养液有着明显的优势,细胞增殖迅速,生长趋势明显,细胞量可达到2.4×105/mL,是四种培养液里面峰值最高的一组,8-12 d细胞数量虽未再增加,但无明显下降。
2.5最适血清浓度
15%的血清浓度最适于BC-Fin生长。分别添加5%、10%、15%、20%FBS于L-15培养液,置于25 ℃培养箱下,细胞生长有明显不同(图5),经统计分析得出血清浓度为5%和10%下的细胞生长较慢,且血清浓度为5%培养下细胞数在12 d时已少于接种数目,10%FBS的细胞数量在12 d时数量增加较少;在含15% 和20% FBS的L-15培养液中,细胞数量增长较快,在第8 d时达到峰值约为2.7×105/mL;但考虑到细胞单层及在保持细胞形态方面,15%的血清浓度优越于20%。

图4 BC-Fin 细胞在不同培养液中的生长比较

图5 BC-Fin 细胞在不同血清浓度中的生长比较
2.6最适培养温度
使用含15% FBS的L-15培养液,如图6所示,25 ℃为最佳培养温度。 分别在15、20、25、30 ℃四个温度梯度下培养,细胞计数显示15 ℃ 和20 ℃不利于细胞的生长,在此温度下,细胞的数目没有明显变化,在12 d时细胞数量已出现下降;在25 ℃ ,细胞贴壁较快,生长迅速,对数生长期较长,在第8 d时达到峰值4.5×105/mL,是四个温度下细胞数量的最高值;在30 ℃,细胞迅速生长,且最早达到峰值,但是峰值较小,达到峰值后细胞出现老化,细胞数量有所下降,细胞不能稳定生长。

图6 BC-Fin 细胞在不同温度中的生长比较
2.7细胞群体倍增
第16代青鱼鳍条细胞的生长曲线如图7所示。细胞培养的1-5 d为青鱼鳍条细胞的对数生长期,5-7 d细胞单层稳定,细胞增殖速度明显缓慢。根据公式T=t×lg2/lg(Nt/N0)计算细胞的群体倍增时间,其中Nt为t时间的细胞数, N0为接种细胞数。计算结果显示,第16代鳍条细胞的群体倍增时间为60.6 h。

图7 第16代BC-Fin细胞的生长曲线
2.8细胞染色体分析
BC-Fin细胞染色体统计结果显示,第16代青鱼鳍条细胞的染色体数目为2n=48(图8),与已经报道的青鱼染色体数目2n=48相符[7]。第41代青鱼鳍条细胞染色体数目分布在32~56之间,染色体众数为46 (图9),表明第41代的BC-Fin 细胞染色体数目已发生变化。
2.916S rRNA 分析
采用青鱼16S rRNA基因特异性引物进行PCR扩增,获得了一段长度为320 bp扩增产物(图10),与预期结果一致。经对该片段测序与序列比对分析,结果显示其序列与来自青鱼的16S rRNA 基因(GQ406278.1)序列同源性为98%,证明此细胞来源于青鱼。

图8 第16代BC-Fin 细胞染色体

图9 第41代BC-Fin 细胞染色体数目分布

图10 BC-Fin细胞16S rRNA基因PCR扩增产物
2.10病毒敏感性
用GCRV-JX0901感染青鱼鳍条细胞,感染后第3天,细胞开始收缩变圆、折光度增加,细胞单层收缩。感染后第6天,细胞碎片增多,细胞脱落,单层呈破渔网状,出现典型细胞病变效应(CPE)(图11A),而对照组正常(图11B)。采用微量培养板培养法测定病毒滴度为105.33±0.21TCID50/mL。细胞培养病毒的分子检测结果显示,RT-PCR扩增出的片段为461 bp ,与预期结果相一致,且条带单一(图12)。表明BC-Fin细胞对GCRV-JX0901敏感,GCRV-JX0901病毒可在BC-Fin细胞上增殖。

图11 GCRV-JX0901感染BC-Fin细胞

图12 GCRV-JX0901 RT-PCR检测结果
3讨论
原代细胞培养方法主要有组织块移植法、酶消化法、机械分散法、络合剂分散法等[8]。常用的是组织块移植法和胰酶消化法,比较这两种原代细胞培养法的优缺点,组织块法更适用于难以消化的组织,考虑到鳍条组织质地坚硬,选择组织块法对青鱼鳍条细胞进行原代培养。采用酶消化法对青鱼鳍条细胞进行传代培养,一般以1∶2的比例分瓶传代。传代培养时选择生长末期或平台期的细胞为宜。细胞是否可以长期冻存和成功复苏,对于建立稳定的细胞系至关重要。本实验中,采用液氮保存法,经过程序降温盒在-80 ℃梯度式降温后放入液氮中,有效避免了细胞在降温过程中冰晶形成造成的伤害[3,8]。细胞复苏后,生长状态良好,形态与冻存之前无差别,经台盼蓝染色后计数,细胞复苏的成活率达约(90.09±4.65)%。证明此细胞可长期保存于液氮中。值得注意的是,经过复苏的细胞在细胞贴壁后要尽早更换培养液,以便较早去除培养基中的DMSO,实验过程中发现较早更换培养液的细胞状态好于较晚更换培养液的细胞。
BC-Fin细胞系生物学特性研究发现,含15%的胎牛血清的L-15培养液于25 ℃培养条件下培养,BC-Fin生长最好,细胞群体倍增时间为60.6 h。L-15培养液采用磷酸盐缓冲体系,氨基酸组成进一步改良,并由半乳糖替代了葡萄糖,使用于无二氧化碳下培养细胞,且此培养液用于多种细胞的培养[3,9]。胎牛血清中含有丰富的营养物质,可以促进细胞贴壁和生长,保护细胞免受重金属离子、蛋白酶等物质的损害[3];但当血清浓度过高时会产生较多的代谢产物,甚至会抑制细胞增长,因此选择适合的血清浓度至关重要。BC-Fin细胞系的胎牛血清浓度为15%时,细胞表现出最佳生长性能。青鱼鳍条细胞最适温度为25 ℃,与青鱼的养殖温度22~28 ℃基本一致。生长因子主要通过与酪氨酸激酶性受体结合,刺激细胞增殖[11],bFGF 因子是一种阳离子多肽,具有刺激成纤维细胞分裂能力的作用[10]。在培养半滑舌鳎细胞时使用EGF和bFGF,亦发现这些生长因子具有促进鱼类细胞增殖的作用[11]。本试验中在进行青鱼鳍条组织细胞原代培养时,于培养基中添加适量EGF和bFGF,可明显促进组织块中细胞迁出形成生长晕以及细胞增殖。
16S已被广泛用于鉴定细胞来源。本实验中通过PCR扩增技术,获得了青鱼线粒体中的16S rRNA基因片段,从分子水平上可确定此细胞系来源于青鱼。细胞染色体分析是鉴定细胞系的重要依据。通过对第16代BC-Fin细胞系进行染色体分析发现,BC-Fin细胞系二倍体染色体数目为2n=48,与基于正常染色体数目一致,但第41代细胞的染色体数目分布在32~56区间,众数为46。染色体数目的变化可能是由于细胞为了适应体外环境,在长期的传代培养中染色体发生了缺失、畸变、断裂或重组等。染色体的变异也会导致一些功能的丧失,因此基于细胞的体外研究应尽量选择早期传代细胞。
细胞系是分离培养病毒病原的重要基础材料。青鱼来源细胞系的缺乏,制约有关青鱼出血病等病毒病的研究进展。本研究采用草鱼呼肠孤病毒GCRV-JX0901毒株感染青鱼鳍条细胞,细胞出现了明显病变效应,证明此细胞系对GCRV敏感。这与养殖生产过程中观察到的草鱼出血病呼肠孤病毒可以感染养殖青鱼的结果一致[12]。草鱼对GCRV高度敏感,GCRV感染草鱼可导致草鱼大量死亡。同时,草鱼呼肠孤病毒亦能感染养殖青鱼,导致青鱼出血病的发生,但死亡率低于草鱼出血病,我们推测,草鱼呼肠孤病毒感染青鱼可能有不同的感染和致病机理。
参考文献:
[1]吴宇略.青鱼鱼病概况及其防治策略[J].渔业致富指南,2010,(21):51-52.
[2]翟子玉,柯鸿文,俞豪祥,等.青鱼出血病的初步研究[J].水产科技情报,1985,(1):9-12.
[3]薛庆善.体外培养的原理与技术[M].北京:科学出版社,2001,87-101.
[4]Freshney R I.Culture of animal cells:a manual of basic technique,6th[M].New Jersey:Wiley-Liss,Inc,2010.
[5]肖艺,曾令兵,徐进,等.锦鲤鳍条组织细胞系的建立及其生物学特性[J].中国细胞生物学学报,2012,34(8):767-774.
[6]Wang G,LaPatra S,Zeng L,et al.Establishment,growth,cryopreservation and species of origin identifi cation of three celllines from white sturgeon,Acipenser transmontanus[J].Methods Cell Sci 2003;25(3/4):211-216.
[7]楼允东,张克俭,吴雅玲,等.青鱼染色体组型的研究[J].水产学报,1983,7(1),78-81.
[8]于淼,管华诗,郭华荣,等.鱼类细胞培养及其应用[J].海洋科学,2003,27,(3):1-8.
[9]Qin Q W,Wu T H,Jia T L,et al.Development and characterization of a new tropical marine fish cell line from grouper,Epinephelus coioides susceptible to iridovirus and nodavirus[J].J Virol Methods,2006,131:58-64.
[10]Boonstra J,Rijken P,Humbel B,et al.The epidermal growth factor[J].Cell Biol Int,1995,19(5):413-430.
[11]L.Wang X,Wang N,X.Sha Z,et al.Establishment,characterization of a new cell line from heart of half smooth tongue sole ( Cynoglossus semilaevis )[J].Fish Physiol Biochem,2010,36(4):1181-1189.
[12]陈爱平,江育林,钱冬,等.草鱼出血病[J].中国水产,2015,11(11),213-220.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

