论文:草鱼不同部位肌肉营养成分、肌纤维特性以及脂肪代谢相关基因的表达
草鱼不同部位肌肉营养成分、肌纤维特性以及脂肪代谢相关基因的表达
陈 洁,李大鹏,张志敏,汤 蓉,李 莉,张 曦,肖 琛,孙怡晴,Onxayvieng Kommaly
(华中农业大学水产学院,池塘健康养殖湖北省工程实验室,武汉 430070)
为了探讨草鱼(Ctenopharyngodonidella)不同部位肌肉品质的差异,本研究选取体质量为(1 026.10±145.55)g的草鱼,检测了背部、腹上部、腹底部和尾部肌肉的营养成分、肌纤维组织结构特性以及脂肪代谢相关基因的表达。结果表明,草鱼腹底部肌肉的粗脂肪含量显著高于背部、腹上部和尾部肌肉,而水分含量则显著降低;背部肌肉粗蛋白含量显著高于腹上部、腹底部和尾部肌肉。腹上部肌肉的肌纤维直径显著高于背部、腹底部和尾部肌肉,但其肌纤维密度则显著降低,而最高的肌纤维密度出现在腹底部肌肉;草鱼背部和尾部肌肉肌纤维密度无显著差异。草鱼腹底部肌肉的脂蛋白脂肪酶基因mRNA表达量显著高于草鱼背部、腹上部和尾部肌肉。脂肪酸合成酶和乙酰辅酶A羧化酶α的mRNA表达量在草鱼背部、腹上部、腹底部和尾部肌肉之间无显著差异。研究表明,草鱼不同部位的肌肉营养特性存在显著性差异,肌肉脂肪含量与肌纤维直径呈负相关,与脂蛋白脂肪酶基因的表达量呈正相关。
草鱼(Ctenopharyngodonidella);营养成分;肌纤维;脂肪代谢
Nutritional compositions, muscular fiber properties, and the expression oflipid metabolic related genes in different parts of muscle inCtenopharyngodonidella
随着社会文明的发展,人们对水产品质量安全和鱼肉品质的关注度越来越高。鱼类肌肉品质评价内容包含营养成分、感官特征、质构特性等方面[1],通常从鱼肉的安全性、对人体的健康性和食用的满意度这三个方面来衡量[2]。肌肉营养成分与肌肉品质密切相关,鱼类肌肉中脂肪和蛋白质含量会影响肌肉的感官特征[3]。肌纤维特性被认为是肌肉品质的主要决定因素,肌纤维的横截直径和面积、肌纤维密度都会影响鱼肉品质[4,5]。
草鱼(Ctenopharyngodonidella)是我国淡水养殖规模最大和养殖区域最广的鱼类品种,其2015年养殖产量占据全国淡水养殖总产量的18.54%[6]。肌肉组织是鱼类的主要食用部分。以往研究表明,草鱼背部和腹部肌肉中的水分、灰分、粗蛋白、粗脂肪含量[7]、肌纤维直径和肌纤维密度[8]都存在一定的差异。通过对草鱼机体脂肪分布进行磁共振成像后发现,草鱼肌肉中的脂肪主要蓄积在腹底部[9],而鱼类脂肪的堆积和代谢,往往依赖于包括脂蛋白脂肪酶(Lipoprotein lipase,LPL)、脂肪酸合成酶(Fatty acid synthase,FAS)和乙酰辅酶A羧化酶α(Acetyl-CoA carboxylase α,ACCα)等在内的关键调控酶[10]类作用的发挥。LPL是甘油三酯降解为游离脂肪酸和甘油反应中的限速酶。ACCα是催化脂肪酸合成代谢第一步反应的限速酶,对脂质代谢起着至关重要的作用[11]。此外,FAS也是表征和调控体脂水平的重要基因[12,13]。以往研究表明,武昌鱼(Megalobramaamblycephala)和齐口裂腹鱼(SchizothoraxprenantiTchang)肌肉中LPL和FAS基因的显著性上调,导致了机体肌肉脂肪含量的增加[14,15]。
为了进一步了解草鱼不同部位肌肉品质的差异以及脂肪代谢相关调控基因在不同部位肌肉内的表达,对草鱼背部、腹上部、腹底部和尾部的肌肉品质进行了研究,检测了肌肉常规营养成分、肌纤维特性以及LPL、FAS和ACCα的mRNA表达水平,旨在为今后在草鱼高效养殖和品质改良等方面提供基础研究数据。
1 材料和方法
1.1 实验鱼
实验用草鱼购自湖北省武汉市白沙洲农贸大市场,体长(40.95±1.63)cm,全长(48.58±1.73)cm,体质量(1 026.10±145.55)g,体质健康。试验前,实验草鱼被暂养在华中农业大学水产学院室内循环水养殖试验系统养殖缸内。暂养期间水温控制在15~16 ℃,pH为7.5±0.3,溶氧保持在7 mg/L以上。从中随机选取9尾草鱼进行实验研究。
1.2 实验方法
1.2.1 肌肉样品的采集
采用MS-222(250 mg/L)麻醉实验鱼,测量鱼的体长、全长和体质量。按照肌肉纹理,采集每尾草鱼背部、腹上部、腹底部和尾部肌肉,每个部位肌肉的具体采样方案如图1所示。背部肌肉采集背鳍前端前数第二条肌肉纹理、侧线上方0.5 cm处的肌肉;腹上部肌肉采集背鳍前端前数第二条肌肉纹理、侧线下方1 cm的肌肉;腹底部肌肉采集腹鳍前端前数第二条肌肉纹理处的肌肉;尾部肌肉采集尾柄部的肌肉。每部位肌肉用于营养成分分析、肌纤维组织学观察和脂肪代谢相关基因mRNA水平检测。
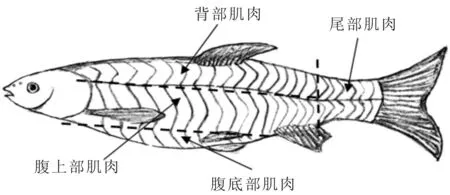
图1 草鱼肌肉样品采集部位Fig.1 Scheme of muscle sampling in C.idella
1.2.2 肌肉常规营养成分的测定
水分含量采用 105 ℃常压干燥法,参考GB 5009.3-2010;粗脂肪采用索氏抽提法测定,参考GB/T 5009.6-2003;灰分采用马弗炉灼烧法测定,参考GB 5009.4-2010;粗蛋白采用凯氏定氮法测定,参考GB 5009.5-2010。
1.2.3 肌纤维组织学观察
采集不同部位肌肉,切块(大小约1.0 cm×1.0 cm×0.5 cm),放入肌肉固定保存液(冰醋酸∶甲醛∶饱和苦味酸=1∶5∶15)中,采用组织学石蜡切片技术和苏木素-伊红染色,使用Nikon Eclipse 80i显微镜观察肌纤维组织结构,用Image-pro plus软件对肌纤维直径和密度进行测量。使用肌纤维直径和密度两个指标衡量不同部位肌肉的肌纤维特性。
1.2.4 脂肪代谢相关基因mRNA水平检测
总RNA提取及cDNA合成:使用Trizol进行肌肉组织总RNA提取,通过电泳检测提取的RNA质量,并用核酸分析仪测定其纯度。采用Prime Script RT reagent Kit with gDNA Eraser(TaKaRa)反转录试剂盒,按照说明书方法进行cDNA合成。
基因的引物设计:根据GenBank中已有的LPL、FAS和ACCα,用 Primer 5.0软件设计特异性引物。定量PCR以β-actin为内参基因,引物由上海生工生物工程技术服务有限公司合成,引物序列见表1。
实时荧光定量PCR:反应体系包括SYBRPremix Ex TaqTMⅡ(TaKaRa)12.5 μL,cDNA模板2 μL,上下游引物各0.5 μL,双蒸水9.5 μL。PCR反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。
1.2.6 数据统计及分析
草鱼LPL、ACCα和FAS相对表达水平采用2-ΔΔCt法计算。所得数据以平均值±标准差表示,用Graphpad PrismV5.0和Origin作图。运用皮尔森相关性分析法检验不同部位肌肉粗脂肪含量与肌纤维直径以及基因表达水平之间的相关性。采用SPSS 18.0统计分析软件对数据进行单因素方差分析(One-way ANOVA),Duncan’s法多重比较分析。当P<0.05时,差异显著;当P<0.01时,差异极显著,当P<0.001时,差异极其显著。

表1 脂肪代谢相关基因的引物序列
2 结果
2.1 草鱼不同部位肌肉的营养成分
草鱼不同部位的营养成分存在显著差异。腹底部肌肉的粗脂肪含量显著高于背部、腹上部和尾部肌肉(P<0.01),而腹底部肌肉的水分含量极显著低于其他部位肌肉(P<0.01)。背部粗蛋白含量显著高于腹上部、腹底部和尾部肌肉(P<0.05),草鱼不同部位肌肉的灰分含量无显著性差异(表2)。

表2 草鱼不同部位肌肉的营养成分含量
注:表中同行数据右上角不同上标字母代表差异显著(P<0.05),下同。
2.2 草鱼不同部位肌肉的组织学结构
由图2和表3可知,草鱼腹上部肌肉的肌纤维直径要显著大于草鱼背部、腹底部和尾部肌肉(P<0.05),背部、腹底部和尾部肌纤维直径之间无显著差异。腹底部肌肉的肌纤维密度显著高于背部、腹上部和尾部肌肉(P<0.05),而最低的肌纤维密度则出现在腹上部(P<0.05),草鱼背部和尾部肌肉之间的肌纤维密度无显著差异。

图2 草鱼不同部位肌肉的组织学结构(横切,×200)Fig.2 Histological structure of the different parts of muscle in C.idella (Transection,×200)A:背部肌肉;B:腹上部肌肉;C:腹底部肌肉;D:尾部肌肉 表3 草鱼不同部位肌肉的肌纤维直径和密度 Tab.3 Muscular fiber diameter and density in the different parts of muscle in C.idella

测量项目背部腹上部腹底部尾部肌纤维直径/μm19838±5362b27244±7355a18116±4620b21610±3537b密度/(根·单位面积-1)3932±256a2092±135b4755±223c3318±345a
2.3 草鱼不同部位肌肉脂肪代谢相关基因的表达
腹底部肌肉的LPL基因mRNA相对表达量显著高于草鱼背部、腹上部和尾部肌肉 (P<0.01),FAS和ACCα的mRNA相对表达量在草鱼背部、腹上部、腹底部和尾部肌肉中无显著差异(图3)。

图3 草鱼不同部位肌肉中LPL、FAS和ACCα基因的mRNA相对表达量Fig.3 The mRNA expression level of LPL, FAS, and ACCα in the different parts muscle of C.idella草鱼腹上部肌肉中的表达丰度设定为1,不同英文字母表示差异显著(p<0.05)。
2.4 肌肉粗脂肪含量与肌纤维直径和脂肪代谢基因表达量之间的相关性分析
如图4和图5所示,肌肉粗脂肪含量与肌纤维直径呈负相关(P<0.01),草鱼肌肉的粗脂肪含量与LPL mRNA相对表达量之间呈正相关(P<0.001)。草鱼肌肉的脂肪含量与FAS和ACCα mRNA相对表达量之间无显著相关。

图4 草鱼不同部位肌肉粗脂肪含量与肌纤维直径的相关性分析Fig.4 Correlation analysis between crude lipid content and muscular fiber diameter in the different parts of muscle in C.idella

图5 草鱼不同部位肌肉粗脂肪含量与LPL mRNA相对表达量的相关性分析Fig.5 Correlation analysis between Crude lipid content and LPL relation mRNA levels in the different parts of muscle in C.idella
3 讨论
鱼肉以其高蛋白、低脂肪、富含EPA和DHA以及人体多种必需氨基酸受到广大消费者的欢迎。草鱼作为我国重要淡水养殖鱼类,是国民饮食中优质蛋白质来源。本研究发现,草鱼不同部位肌肉的营养成分存在显著性差异,草鱼背部肌肉粗蛋白含量最高,腹底部肌肉中脂肪含量最高。以往研究也发现鲽(Hippoglossushippoglossus)、齐口裂腹鱼背部粗蛋白含量显著性高于腹部肌肉[15,16]。此外,草鱼、罗非鱼(Oreochromisniloticus)和大黄鱼(Pseudosciaenacrocea)等鱼类的腹部肌肉脂肪含量也高于背部肌肉[10]。这与我们的研究结果一致。这说明,同一种鱼类的不同部位肌肉营养成分也存在显著性的差异[16]。
肌肉纤维是骨骼肌的主要组成成分,鱼体骨骼肌约占活体重量的30%~80%[17]。在鱼类生长过程中,肌肉生长是肌纤维增生和增粗的结果[4],受内在基因调控和外界环境的共同影响[18-22]。肌纤维特性包括不同肌纤维类型的数量和比例、肌纤维密度和直径、肌纤维横截面积。鱼类肌纤维特性和结缔组织的含量,都与鱼类肌肉品质密切相关,肌纤维的直径和密度与肌肉质构特性(如硬度、弹性、咀嚼性等)有关[23]。在草鱼的研究中发现肌纤维直径减小,肌纤维数目增多[24,25]。在很多高等动物的研究中,肌肉脂肪含量与肌纤维密度和直径有一定的相关性[26,27]。本研究中发现草鱼腹底部肌肉的粗脂肪含量蓄积最多,同时草鱼腹底部肌肉的肌纤维直径最小,且肌肉中粗脂肪含量与肌纤维直径成负相关关系。对高等动物的研究也发现了肌肉脂肪含量与肌纤维直径呈负相关的规律[28]。这说明鱼类肌肉脂肪含量与肌纤维直径存在一定的负相关关系。
鱼类肌肉品质的高低往往与其脂肪含量的多少有密切的关系[3]。研究脂肪代谢相关基因在鱼体不同部位肌肉中的表达差异情况,可以从基因水平上探究调控草鱼肌肉脂肪沉积的机制。鱼类组织中积累的脂肪来自摄入的外源脂肪和体内自身合成的内源脂肪,超过机体各组织需求的外源性脂肪在肝脏中转变为三酰甘油,并与特定的载脂蛋白包装成极低密度脂蛋白(VLDL),VLDL从肝脏进入血液,再运至肌肉和脂肪组织,激活组织中的FAS,LPL将VLDL中的脂肪酸水解形成游离脂肪酸,再由脂肪细胞吸收并转变为三酰甘油储存于细胞中,游离脂肪酸同时也可以用于氧化供能。内源性脂肪的合成是一系列的酶促反应,在脂肪酸合成过程中,乙酰辅酶A在ACCα催化下形成丙二酸单酰辅酶A,乙酰辅酶A和丙二酸单酰辅酶A在FAS的作用下形成脂肪酸[29]。在本研究中草鱼腹底部肌肉的LPL基因的表达量显著高于草鱼背部、腹上部和尾部肌肉,而FAS和ACCα的表达量在草鱼背部、腹上部、腹底部和尾部肌肉中无显著差异。同时,草鱼肌肉的粗脂肪含量与LPL mRNA相对表达量之间呈正相关性。在金头鲷(Sparusaurata)、虹鳟(Oncorhynchusmykiss)的研究中发现,鱼体肌肉粗脂肪含量增加时,LPLmRNA的表达量也显著性的上调[30,31],这与本研究结果一致,说明草鱼腹底部LPL mRNA的表达与腹底部脂肪的积累存在一定的相关性。
综上所述,草鱼不同部位肌肉的常规营养成分存在显著性差异,与肌纤维直径以及脂肪代谢基因LPL mRNA的表达存在相关性。草鱼肌肉脂肪含量与LPL mRNA相对表达量呈正相关,与肌纤维直径呈负相关关系。
[1] Huss H H. Quality and quality changes in fresh fish[M]. Food & Agriculture Org,1995.
[2] Listrat A, Lebret B, Louveau I, et al. How muscle structure and composition influence meat and flesh quality[J]. Sci World[J], 2016,(6):1-14.
[3] Lie Ø. Flesh quality - the role of nutrition[J]. Aquac Res, 2002, 32(s1):341-348.
[4] Johnston I A. Muscle development and growth: potential implications for flesh quality in fish[J]. Aquaculture, 1999, 177(1):99-115.
[5] Rehfeldt C, Fiedler I, Dietl G, et al. Myogenesis and postnatal skeletal muscle cell growth as influenced by selection[J]. Livest Prod Sci, 2000, 66(2):177-188.
[6] 农业部渔业渔政管理局. 2016中国渔业统计年鉴[M]. 北京:中国农业出版社,2016:31.
[7] 安玥琦, 徐文杰, 李道友, 等. 草鱼饲喂蚕豆过程中肌肉质构特性和化学成分变化及其关联性研究[J]. 现代食品科技, 2015 (5):102-108.
[8] 林婉玲, 杨贤庆, 李来好,等. 脆肉鲩质构与感官评价的相关性研究[J]. 现代食品科技, 2013(1):1-7.
[9] Wu J L, Zhang J L, Du X X, et al. Evaluation of the distribution of adipose tissues in fish using magnetic resonance imaging (MRI)[J]. Aquaculture, 2015, 448:112-122.
[10] Björntorp P. The regulation of adipose tissue distribution in humans[J]. Int J Obesity, 1996, 20(4):291-302.
[11] Zheng J L, Luo Z,Zhu Q L, et al. Molecular cloning and expression pattern of 11 genes involved in lipid metabolism in yellow catfishPelteobagrusfulvidraco[J]. Gene, 2013, 531(1): 53-63.
[12] Tian J, Wen H, Zeng L B, et al. Changes in the activities and mRNA expression levels of lipoprotein lipase (LPL), hormone-sensitive lipase (HSL) and fatty acid synthetase (FAS) of Nile tilapia (Oreochromisniloticus) during fasting and re-feeding[J]. Aquaculture, 2013, 400: 29-35.
[13] 梁 琍, 蒋左玉, 安 苗, 等. 普安银鲫早期发育中 ACCα 和 FAS 基因表达及外源物质的影响[J]. 淡水渔业, 2015, 45(4):15-19.
[14] 夏晓杰, 邬应龙, 冯 姣, 等. 齐口裂腹鱼生长、肌肉品质和脂蛋白脂酶及脂肪酸合成酶基因表达的研究[J]. 食品科学, 2015,(1):164-169.
[15] Li X F, Jiang G Z, Qian Y, et al. Molecular characterization of lipoprotein lipase from blunt snout breamMegalobramaamblycephala, and the regulation of its activity and expression by dietary lipid levels[J]. Aquaculture, 2013,(2):23-32.
[16] Nortvedt R, Tuene S. Body composition and sensory assessment of three weight groups of Atlantic halibut (Hippoglossushippoglossus) fed three pellet sizes and three dietary fat levels[J]. Aquaculture, 1998, 161(1):295-313.
[17] Weatherley A H, Gill H S. The biology of fish growth[M]. Academic Press, 1987.
[18] Nettleton J A, Exler J. Nutrients in wild and farmed fish and shellfish[J]. Food Sci, 1992, 57(2):257-260.
[19] Orban E, Lena G D, Nevigato T, et al. Quality characteristics of sea bass intensively reared and from lagoon as affected by growth conditions and the aquatic environment[J].J Food Sci, 2002, 67(2):542-546.
[20] Periago M J, Ayala M D, López-Albors O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass,DicentrarchuslabraxL[J]. Aquaculture, 2005, 249(1):175-188.
[21] 李小勤, 胡 斌, 冷向军, 等. VE 对草鱼成鱼肌肉品质和抗氧化性能的影响[J]. 水生生物学报, 2009, 33(6):1132-1139.
[22] Nathanailides C, Lopez-Albors O, Abellan E, et al. Muscle cellularity in relation to somatic growth in the European sea bassDicentrarchuslabrax(L.)[J]. Aquac Res, 1996, 27(11): 885-889.
[23] Lin W L, Zeng Q X, Zhu Z W. Different changes in mastication between crisp grass carp (CtenopharyngodonidellusC.et V) and grass carp (Ctenopharyngodonidellus) after heating: The relationship between texture and ultrastructure in muscle tissue[J]. Food Res Int, 2009, 42(2):271-278.
[24] 林婉玲,关 熔,曾庆孝,等.影响脆肉鲩鱼背肌质构特性的因素[J]. 华南理工大学学报(自然科学版),2009,37(4):134-137.
[25] 刘建波, 陈开健, 佘曙明, 等. 脆肉鲩肌肉超微结构分析[J].水利渔业, 2005, 25(3):65-67.
[26] Karamichou E,Richardson R I,Nute G R, et al. Genetic analyses of carcass composition, as assessed by X-ray computer tomography, and meat quality traits in Scottish Blackface sheep[J]. Anim Sci, 2006, 82(2):151-162.
[27] 沈元新, 徐继初. 金华猪及其杂种肌肉组织学特性与肉质的关系[J]. 浙江大学学报,1984,10(3):265-272.
[28] Bünger L, Navajas E A, Stevenson L, et al. Muscle fibre characteristics of two contrasting sheep breeds: Scottish Blackface and Texel[J]. Meat Sci, 2009, 81(2):372-381.
[29] Leaver M J, Bautista J M, Björnsson B T, et al. Towards fish lipid nutrigenomics: Current state and prospects for fin-fish aquaculture[J]. Rev Fish Sci, 2008, 16(sup 1):71-92.
[30] Albalat A, Sánchez-Gurmaches J, Gutiérrez J, et al. Regulation of lipoprotein lipase activity in rainbow trout (Oncorhynchusmykiss) tissues[J]. Gen Comp Endocr, 2006, 146(3):226-235.
[31] Saeravila A, Calduchginer J A, Gómezrequeni P, et al. Molecular characterization of gilthead sea bream (Sparusaurata) lipoprotein lipase. Transcriptional regulation by season and nutritional condition in skeletal muscle and fat storage tissues[J]. Comp Biochem Phys B, 2005, 142(2):224-232.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

