论文:黄鳍金枪鱼幼鱼体长与血液指标关系研究
黄鳍金枪鱼幼鱼体长与血液指标关系研究
周胜杰,杨 蕊,于 刚,马振华
(1. 中国水产科学研究院南海水产研究所热带水产研究开发中心,海南 三亚 572018; 2. 农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300; 3. 三亚热带水产研究院,海南 三亚 572018)
电解质水平是机体生理功能的保障,具有影响机体新陈代谢、调节心脏和肌肉指标水平等功能[1]。血气分析指标中血乳酸水平、葡萄糖水平、离子浓度等均有重要的指示作用。例如,在人类疾病检测中,血乳酸水平检测对于B族链球菌感染败血症新生儿早期诊断具有重大临床意义[2];血糖测定是诊断糖尿病的最主要检查项目之一,同时也是多种人体疾病检查的重要指标[3]。血清中的离子具有保证酸碱平衡、调节体液渗透压和维持细胞新陈代谢的功能[4]。其中钾离子 (K+)、钠离子 (Na+) 主要以碱盐的形式存在于组织及细胞中,对酸碱平衡有重要调节作用;钙离子 (Ca2+) 对神经信号的传递、激素分泌、酶活性等具有重要作用[4]。血清离子水平通常用于反映人体健康状况[5],如儿童热性惊厥[6]、老年心血管疾病[5]、脑梗死[7]等的诊断。电解质水平在鱼体中也有重要的作用,研究表明当鲤 (Cyprinus carpio) 发生暴发性疫病时,病鱼血清中K+、Na+浓度有较明显的升高,而对Ca2+的影响较小[4]。关于电解质水平在鱼类研究中的应用较少,多数相关研究集中在广盐性鱼类及海水鱼类的离子转运能力及离子通道研究上[8-9]。
广盐性鱼类在降海洄游和溯河洄游过程中因外界离子浓度变化较大,导致渗透压发生变化,机体失水或吸水,为了维持体内稳态,广盐性鱼类具有调节渗透压、酸碱度和离子的功能器官,因此可以在淡水与海水之间穿梭[8]。海水鱼类在摄食过程中会吞食大量高盐海水,亦具有强大的离子调节器官[10]。钠钾ATP酶 (NKA)、钙镁ATP酶 (CMA)是调节鱼类离子平衡的重要参与者[9],多种激素如催乳素(PRL)、生长激素 (GH)、类胰岛素生长因子-1 (IGF-1) 的介导亦与之密切相关[11],通过刺激转运蛋白合成影响氯细胞的增殖、分化等方式促进对水分和离子的转运能力[12-13]。多种与之相关的活动均是为了维持机体的离子平衡,可见离子平衡的重要性。目前关于鱼类血液指标方面的研究主要集中在外界环境因子 (pH、温度、盐度等) 胁迫对血液抗氧化酶活性、免疫酶活性等指标的研究[14-18]。鱼类血液电解质稳态相关的研究较少。通过检测鱼类血液电解质基础指标,积累数据,可类比人类医学,为鱼类生长健康评价提供思路。
金枪鱼是高营养价值鱼类,为最受推崇的海水鱼类之一。从分类上看,一般将鲭科的金枪鱼属、鲣属、鲔属、舵鲣属、狐鲣属统称为金枪鱼类。但大众通常只将该名词与金枪鱼属的大型高价值物种联系起来,如蓝鳍金枪鱼(Thunnus albacares)、黄鳍金枪鱼 (T. thynnus) 和大目金枪鱼(T. obesus)。金枪鱼类具有高度洄游的特性,广泛分布于世界三大洋的热带和温带水域,全球共17种,它们的共同特征是有发达的皮肤血管系统,体温高出水温1~2 ℃。因其营养丰富、味道鲜美而深受喜爱[19]。黄鳍金枪鱼为鲭科、金枪鱼属的一种鱼类,最大体长可达3 m,体质量可达225 kg。目前,关于黄鳍金枪鱼的研究主要集中在肌肉营养成分、捕捞方式方法、鱼群分布、开发利用及保鲜运输等[20-27]。国内关于黄鳍金枪鱼养殖研究的公开报道较少,Ma等[28]曾报道过美济礁深水网箱养殖黄鳍金枪鱼幼鱼的驯化摄食水深,方伟等[29]开展了5月龄黄鳍金枪鱼幼鱼形态性状对体质量的相关性及通径分析。世界范围内,澳大利亚、日本、墨西哥、巴拿马等国家已开展了黄鳍金枪鱼养殖,取得了良好的成果。目前商业养殖黄鳍金枪鱼幼鱼主要来自于野生苗种诱捕,养殖方式主要为网箱养殖。我国黄鳍金枪鱼陆基循环水驯化养殖技术刚起步[30]。目前关于黄鳍金枪鱼幼鱼陆基循环水养殖基础数据较少,不同体长血清指标差异的研究尚未见报道。本研究开展了不同体长黄鳍金枪鱼幼鱼血清基础数据测定,旨在为黄鳍金枪鱼陆基养殖积累基础数据,为其幼鱼疾病诊断提供思路,有利于构建设施化金枪鱼养殖技术体系,为我国后续开展金枪鱼深远海养殖和陆基循环水养殖推广奠定基础。
1 材料与方法
1.1 材料来源
黄鳍金枪鱼幼鱼体长25.78~49.21 cm,体质量410~2580 g,共计48尾,由中国水产科学研究院深远海养殖技术与品种开发创新团队于2020年11月—2021年1月在海南陵水黎族自治县新村镇附近海域诱捕,转运至基地后进行驯化养殖。
1.2 实验方法
黄鳍金枪鱼幼鱼自诱捕后在基地驯养池中进行驯化养殖,养殖池规格为长8.6 m×宽5.6 m×高2.8 m。驯化环境参数为水温 (22.5±0.5) ℃,溶解氧质量浓度>8.50 mg·L−1,pH 为 7.93±0.12,盐度为 33,氨氮质量浓度<0.1 mg·L−1,亚硝态氮质量浓度<0.1 mg·L−1,实验用鱼体质量 410~2 580 g。黄鳍金枪鱼幼鱼驯化期间投喂新鲜杂鱼,驯化成功后按体长将其分为 3组:20G (20~30 cm)、30G (30~40 cm)、40G (40~50 cm),每组 16尾,每组随机抽取 3尾分别测定血液、体质量、体长指标等。
黄鳍金枪鱼幼鱼经丁香酚 (10~30 μg·L−1) 麻醉后,用一次性注射器 (注射器用抗凝剂肝素润洗) 从其尾部抽取血液样品 (每尾取血 4 mL) 并按照比例加入抗凝剂 [每毫升血液肝素用量为 (15±2.5) U],4 ℃ 保存并静置 30 min,静置完成后用台式高速冷冻离心机 (EXPERT 18K-R) 离心(温度 4 ℃,转速 3 000 r·min−1,时长10 min)。提取上清液后使用血气分析仪PL2000 Plus测定样品。测定K+、Na+、Ca2+、标准化 Ca2+、氯离子 (Cl−)、渗透压、氢离子 (H+)、pH、葡萄糖、乳酸、总血红蛋白浓度和红细胞比容等数据,采用仪器专用试剂包测定,数据精确到小数点后两位。
1.3 数据计算与分析
标准化离子钙:即pH 7.4时的钙离子浓度。采用Excel 2010软件进行数据整理,用SigmaPlot 14作图,通过SPSS 19.0软件进行显著性差异分析。
2 结果
2.1 黄鳍金枪鱼主要离子浓度与体长的关系
本实验中不同体长组黄鳍金枪鱼幼鱼血清K+浓度和Ca2+浓度之间均存在差异 (图1-a),均为30G组浓度最高[K+为 (13.85±3.49) mmol·L−1,Ca2+为 (2.96±0.32) mmol·L−1],但是不同组间差异均不显著 (P>0.05)。标准化离子钙(图1-c) 浓度也呈现同一规律,但是30G组的浓度[(2.89±0.45) mmol·L−1]显著高于其他两组 (P<0.05)。Na+浓度随着体长的增加逐渐降低,随着体长的增加由 (286.05±0.55)mmol·L−1降低至 (244.87±30.53) mmol·L−1,相邻体长组之间差异不显著 (P>0.05),但是20G与40G组间差异显著(P<0.05)。Cl−的浓度随着体长的增加逐渐升高,由(194.05±1.35) mmol·L−1上升至 (215.60±27.67) mmol·L−1,各组间差异不显著 (P>0.05)。20G组渗透单位显著高于其他两组,达607.90 mOsm·kg−1,30G与40G组之间平均值相近且差异不显著 (P>0.05,图1-d)。
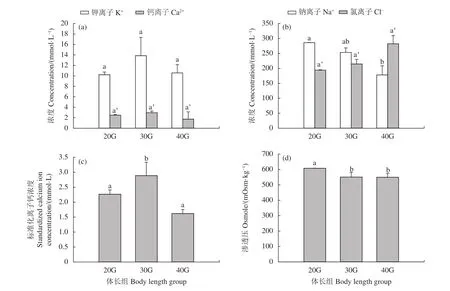
图1 黄鳍金枪鱼幼鱼主要离子浓度与体长关系Osm为渗透单位;不同字母表示差异显著 (P<0.05),反之差异不显著 (P>0.05),后图同此。Figure 1 Relationship between main ion concentration and body length of juvenile yellowfin tunaOsm is the unit of penetration; different and the same letters indicate significant difference (P<0.05) and insignificant difference (P>0.05). The same in the following figures.
2.2 黄鳍金枪鱼幼鱼不同体长H+浓度和pH差异
黄鳍金枪鱼幼鱼3个体长组之间H+浓度和pH差异均不显著 (P>0.05),但是变化规律有所差别。H+浓度随着体长的增加逐渐降低,而pH随着体长的增加逐渐上升。20G 组 H+浓度 [(58.60±0.90) mmol·L−1]明显高于其他两组,30G 和 40G 组之间差异较小,分别为 (45.68±11.98) mmol·L−1和 (44.10±16.67) mmol·L−1。3组 pH 依次为 7.23±0.01、7.35±0.12、7.38±0.19,差异较小 (图 2)。

图2 黄鳍金枪鱼幼鱼体长与氢离子浓度、pH的关系Figure 2 Relationship between body length and hydrogen ion concentration and pH of juvenile yellowfin tuna
2.3 黄鳍金枪鱼幼鱼不同组间葡萄糖、乳酸、总血红蛋白浓度和红细胞比容的差异
黄鳍金枪鱼幼鱼血清葡萄糖和乳酸浓度均呈逐渐下降的趋势 (图3-a)。不同的是,各组间的葡萄糖浓度差异不显著 (P>0.05),分别为 (0.86±0.38)、(0.81±0.73)、(0.35±0.34)mmol·L−1;20G 组乳酸浓度 [(18.69±0.20) mmol·L−1]显著高于其他两组 [(7.75±1.47)、(4.99±4.02) mmol·L−1,P<0.05]。黄鳍金枪鱼幼鱼血清红细胞比容在3个体长组之间呈现先下降后上升的趋势,3组间差异不显著 (P>0.05),分别为 (21.4±0.50) %、(14.63±3.21) % 和 (16.50±4.60) %(图3-b)。黄鳍金枪鱼血清总血红蛋白浓度随着体长增加逐渐下降,20G组显著高于其余两组 (P<0.05,图3-c)。3组总血红蛋白质量浓度分别为 (68.35±1.75)、(45.85±10.78)、(41.77±15.81) g·L−1。

图3 黄鳍金枪鱼幼鱼体长与葡萄糖、乳酸、红细胞比容、总血红蛋白浓度的关系Figure 3 Relationship between body length and glucose,lactate, hematocrit and total hemoglobin concentration of juvenile yellowfin tuna
3 讨论
血清中的主要离子如Na+、K+、Ca2+、Cl-等是血液离子的主要组成部分,对离子平衡、心脏跳动等机体活动有重要作用,也是机体健康与否的重要指示指标。血清中葡萄糖、乳酸、渗透压和总血红蛋白浓度等均是人体健康检查的重要血液指标。目前关于鱼类血液方面的研究主要针对血液抗氧化酶、免疫酶活性方面[14-18];关于离子平衡的研究主要集中在鳃ATP酶对Na+、K+等离子的转运能力方面[9]。而有关鱼类血清重要电解质指标方面的研究较少。
3.1 主要离子浓度及渗透压对机体的影响
一般来说,机体内所有元素都存在着直接或间接的关系[31]。血清中主要离子的浓度变化更是医学上作为疾病诊断的重要参考依据,如甲状腺疾病[31]、心脏疾病[5]、脑血管疾病[32]、新生儿败血症[2]等基础性或重大疾病。有研究表明Ca2+水能够提高大鼠的免疫能力[33]。在鱼类研究中,离子变化研究主要集中在广盐性鱼类或海水鱼类上[8]。广盐性鱼类在外界盐度变化时会出现外界与体内离子差的剧烈变化,直接导致鱼体失水或吸水。广盐性鱼类可通过鳃上的离子通道和ATP酶等进行离子和水的获取或排出[9]。海水鱼类在摄食过程中因吞入海水而摄入过多盐分也可以通过泌盐细胞排出体外,并以此来维持体内离子平衡。因此血液主要离子指标也是鱼类重要的健康指示标准。本研究中黄鳍金枪鱼幼鱼血清的K+浓度随体长的增加呈现先升高后降低的现象,但不同组间均差异不显著(P>0.05);随着体长的增加Cl-浓度呈现逐渐升高的现象,各组间差异同样不显著 (P>0.05)。结果表明在本研究涉及的体长范围内,随着体长的增加血清中K+和Cl-浓度相对稳定,仅出现较小的波动。本研究中黄鳍金枪鱼幼鱼血清Na+浓度随着体长的增加逐渐降低,相邻两组之间差异不显著 (P>0.05),但20G与40G组间存在显著差异 (P<0.05)。表明在本研究体长范围内,随着体长的增加血清Na+浓度缓慢下降,并且在体长差距较大时差异显著 (P<0.05)。整体而言,主要离子中K+、Ca2+、Cl-组间差异不显著 (P>0.05),是随着体长变化较稳定的血液指标,可以为黄鳍金枪鱼的疾病检查提供稳定参考。Na+浓度随着体长的增加逐渐下降,是随着体长增加变化规律明显的指标。
血清Ca2+是指示机体是否缺钙的重要指示标准。标准化Ca2+浓度是计算出的浓度,是Ca2+在pH为7.4时的标准化浓度[34]。标准化Ca2+浓度可以排除干扰,更直观地表示其浓度值。本研究中黄鳍金枪鱼幼鱼血清的Ca2+浓度随着体长的增加先升高后降低,但不同组之间均差异不显著(P>0.05)。而标准化Ca2+浓度表现为30G体长组显著高于其他两组。黄鳍金枪鱼标准化Ca2+浓度变化与体长之间没有明显规律,影响其变化的主要因子有待进一步研究。
广盐性鱼类具有较强的渗透压调控能力来适应盐度变化,在高渗环境中广盐性鱼类主要通过吞饮高盐环境水来补充体表丢失的水分,鳃上皮细胞基底膜上的NKA和CMA来调节Na+、K+、Ca2+和Cl-等的平衡以适应外界盐度变化[35-38]。渗透压的变化可以为体液离子平衡能力提供参考,本研究中20G体长组渗透压显著高于其他两组,达607.90 mOsm·kg−1,30G 与 40G组之间平均值相近,且差异不显著 (P>0.05)。渗透压的不同能从侧面反映出其对体液平衡的调节能力。本研究结果表明30G和40G体长组的体液离子平衡能力较强。
3.2 血清H+浓度和pH之间的关系
血液酸碱度即血液内H+浓度的负对数值。酸碱度对机体的作用主要表现在对神经肌肉组织兴奋性的影响。在一定pH范围内,碱性增加,兴奋性提高;酸性增加,兴奋性降低。正常情况下血液酸碱度变化很小,主要依赖于血液中抗酸和抗碱物质形成的缓冲系统和正常呼吸功能及肾排泄功能[39]。如果这些功能不良或受疾病影响,则可能出现酸碱平衡紊乱,表现为酸中毒或碱中毒[39]。环境酸碱度对鱼类影响极大,如抗氧化酶活性、鱼病发生、能量代谢[40-42]等。有研究表明血液pH能够反映机体的健康状况[39]。本研究中黄鳍金枪鱼幼鱼3个体长组间H+浓度和pH差异均不显著 (P>0.05),但是变化规律有所差别。H+浓度随着体长的增加逐渐降低,而pH相对稳定,随着体长的增加轻微上升。
3.3 葡萄糖、乳酸、总血红蛋白浓度和红细胞比容的指示作用
正常情况下,机体中糖的分解和合成代谢处于动态平衡中,保持相对恒定。血清葡萄糖是指血液中的葡萄糖浓度,血糖测定是诊断糖尿病的最主要检查项目之一,同时也是检查多种人体疾病的重要指标[3]。血乳酸是体内糖代谢的中间产物,主要由红细胞、横纹肌和脑组织产生,血液中的乳酸浓度主要取决于肝脏及肾脏的合成速度和代谢率。体内乳酸升高可引起乳酸中毒。检查血乳酸水平,可提示潜在疾病的严重程度[3]。有研究表明,不同养殖环境中淡水鱼血糖浓度有所差异[43]。本研究中,黄鳍金枪鱼幼鱼血清葡萄糖浓度随着体长的增加呈现逐渐下降的趋势,但各组间差异不显著 (P>0.05),是本研究体长范围内随着体长增加浓度稳定降低的血液指标。黄鳍金枪鱼幼鱼血清乳酸浓度随着体长的增加亦呈现逐渐下降的趋势,乳酸在20G 组 [(18.69±0.20) mmol·L−1]显著高于其他两组 (P<0.05)。有研究表明,体内葡萄糖代谢过程中,如糖酵解速度增加,剧烈运动、脱水时,也可引起体内乳酸升高[3]。本研究中血糖与乳酸浓度的变化趋势相同,表明黄鳍金枪鱼在血糖浓度高时可能会分解产生较多的乳酸。红细胞比容指红细胞占全血容积的百分比,其反映红细胞和血浆的比例,是影响血黏度的主要因素[1]。血清红细胞比容在3个体长组之间呈现先下降后上升趋势,3组间差异不显著(P>0.05)。说明在本研究中3个体长组内血清红细胞比容有轻微浮动,但整体差异不大,是较稳定的血液指标。
血红蛋白浓度指单位体积 (L) 血液内所含血红蛋白的量,是一种含色素的结合蛋白质,是红细胞主要成分,能与氧 (O2) 和二氧化碳 (CO2) 结合,具有运输 O2和 CO2的功能,同时可以与某些物质作用形成多种血红蛋白衍生物,是临床诊断某些变性血红蛋白症和血液系统疾病的重要参考依据[44-45]。其增减具有的临床意义与红细胞相似,但血红蛋白对贫血的反映效果更佳明确[44]。在鱼类研究中,测定血红蛋白的研究较少,有研究表明,鱼类的血红蛋白含量受环境因素影响,河流围网养殖状态下的团头鲂(Megalobrama amblycephala)、草鱼 (Ctenopharyngodon idella) 全血血红蛋白值高于池塘养殖状态[43]。本研究中黄鳍金枪鱼血清血红蛋白浓度随着体长的增加逐渐下降,且20G组显著高于其余两组 (P<0.05)。人类幼儿的血红蛋白浓度也高于成年人,与本研究结果相似。说明黄鳍金枪鱼的血红蛋白浓度与体长有较大的关系,与环境的关系有待进一步探索。
4 结论
综上所述,本研究中黄鳍金枪鱼幼鱼在3个体长组中血液指标较稳定。K+、Ca2+、Cl-、H+、pH、葡萄糖、红细胞比容组间差异不显著 (P>0.05),是随着体长变化较稳定的血液指标,可为黄鳍金枪鱼的疾病检查提供参考。Na+、乳酸和总血红蛋白浓度均随着体长的增加逐渐下降,是随着体长增加变化明显的指标,亦可为黄鳍金枪鱼的疾病检查提供参考;标准化Ca2+在30G组显著高于其他两组(P<0.05),其变化规律有待进一步研究。整体而言,随着体长的增加,黄鳍金枪鱼幼鱼血液指标逐渐趋于稳定。血清数据与体长之间的关系研究可为黄鳍金枪鱼幼鱼积累基础生理数据,为养殖过程中疾病的诊断提供参考。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊"!

