论文:镉暴露对鲢幼鱼游泳行为影响的研究
镉暴露对鲢幼鱼游泳行为影响的研究
黄应平1,2,Prashant Mandal1,2,靖锦杰1,2,蒋 清1,2,袁 喜1,2,3,涂志英1,2,胥 焘1,2
(1.三峡库区生态环境教育部工程研究中心(三峡大学),湖北宜昌 443002; 2.三峡地区地质灾害与生态环境湖北省协同创新中心(三峡大学),湖北宜昌 443002; 3.中国科学院水生生物研究所,武汉 430072)
为了探讨水体镉(Cd)污染对鱼类的生态毒理效应,在实验室条件下,测定了不同浓度Cd(0、0.36、0.73、1.09和1.46 mg/L)暴露对鲢(Hypophthalmichthysmolitrix)幼鱼半致死浓度、组织(肝、鳃、肌肉)Cd累积量、相对临界游泳速度(Ucrit)、以及耗氧率(MO2)的影响。结果显示:Cd暴露导致重金属在幼鱼组织中累积,与对照组比较,Cd在鳃和肌肉中累积量差异不显著;肝脏中累积量差异显著,暴露浓度为0.73 mg/L时肝脏中镉累积量最高。鲢幼鱼相对临界游泳速度随着Cd暴露增加显著降低,浓度为1.46 mg/L时Ucrit为对照组的69.75%。临界游泳速度与鳃和肌肉组织中镉累积量呈显著负相关,相关系数分别为-0.96 (P=0.01)和-0.90 (P=0.04)。Cd暴露导致鲢幼鱼耗氧代谢范围增加,暴露浓度为0.73 mg/L时耗氧代谢范围较对照组增加了19.32%。低浓度Cd暴露导致鳃和肌肉损伤,并引起鲢幼鱼游泳过程中耗氧代谢效率降低,有氧运动能力和游泳能力下降。
镉;鲢(Hypophthalmichthysmolitrix);临界游泳速度;耗氧代谢范围
重金属是一类典型的环境污染物,通过暴露或食物链等途径直接或间接地影响鱼类的生理生态行为。鱼类生物(行为)效应对重金属的响应,在一定程度上反映水生生态系统受重金属污染程度[1]。镉是水体常见的重金属污染物,通过生物富集和生物放大效应对水生生态系统产生重要影响,对水生无脊椎动物、两栖动物和鱼类等水生生物均具有较强的毒性[2-3]。镉暴露对鱼的鳃、肌肉、肝脏、肾、脾、大脑和神经系统[4-8]等产生损伤,引起病理行为甚至导致死亡。高浓度镉暴露导致鲤(Cyprinuscarpio)外周血红细胞微核率和核异常率上升,机体损伤性和遗传毒性增强[9]。三峡库区蓄水前重庆江段主要经济鱼类肌肉中镉含量为0.031~0.24 mg/kg;内脏中为0.18~0.75 mg/kg[10],蓄水之后水体总镉含量略有增加[11],库区鱼类的生态风险增加,应引起重视。
游泳行为是鱼类逃逸、捕食和繁殖等行为实现的主要方式[12]。临界游泳速度(critical swimming speed,Ucrit)是最大的稳定游泳速度,通常作为评价鱼类游泳能力的重要指标[13]。临界游泳速度诱导产生的有氧代谢能力可以用最大耗氧率表示,而有氧代谢范围(aerobic metabolic range,MR)反映了鱼类除满足基本生理需求外完成其他有氧生理活动的潜在能力[14],环境的变化能够影响鱼类的这种有氧生理活动的潜在能力[15]。镉对鱼类行为和代谢方面的研究国内外已有报道,慢性亚致死剂量的镉暴露导致鳟(Salmotrutta)和白鲑(Coregonusclupeaformis)重复游泳能力受损,疲劳后耗氧恢复较慢[16]。镉暴露导致黄金鲈(Percaflavescens)肌肉中的二磷酸核苷激酶活性降低,相对耗氧代谢范围显著的降低,而且镉主要影响其鳃的呼吸能力[17]。关于镉暴露对鲢(Hypophthalmichthysmolitrix)幼鱼游泳行为及耗氧率影响的研究未见报道。
本研究通过测定鲢幼鱼镉暴露半致死浓度,不同镉浓度暴露鲢幼鱼组织(肝、鳃、肌肉)镉含量,相对临界游泳速度(Ucrit)和耗氧率(MO2),用于研究镉暴露对鲢幼鱼生态毒理效应、游泳能力和耗氧代谢的影响。考察鲢幼鱼运动和代谢等方面行为对水体镉浓度变化响应灵敏性,用于评价镉污染对鲢幼鱼潜在的生态毒性,扩充水生生物毒性试验材料,为自然水域受镉污染研究提供基础数据。
1 材料与方法
1.1 实验材料
实验用鲢幼鱼购自宜昌养殖场。实验前将鱼在鱼缸(420 L)中驯化2周。每两天投喂饲料1次(蛋白质>38%,脂肪>5%,纤维素<5%,灰分<12%,湿度<11%)。驯养用水为曝气后的自来水,驯养期间曝气使水体溶氧水平接近饱和,日换水量约为水体的1/3,自然水温20±1℃,自然光照。
驯养结束后,选取健康幼鱼60尾,随机平均分配至各浓度梯度组,实验鱼体长、体重参数如表1。根据急性毒性试验结果,本研究共设5个镉(Cd2+)浓度梯度,分别为0(0组)、0.36(1组)、0.73(2组)、1.09(3组)、1.46 mg/L(4组),暴露时间为96 h。暴露期间不投饵,每日定时换水并补充相应浓度的硝酸镉溶液以保持水体镉浓度基本恒定,日换水量为水体的1/2。
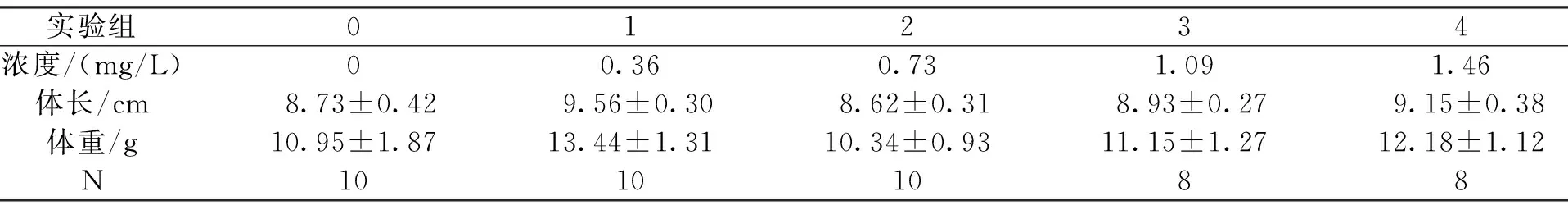
表1 鲢幼鱼的体长、体重参数(平均值±标准误)
1.2 实验方法
临界游泳速度(Ucrit)的测定设备为鱼类游泳能力测定装置,该装置的结构和使用方法详见文献[18]。将在不同梯度的Cd2+暴露96 h后实验鱼转入鱼类游泳能力测定装置中驯化2 h (流速为10 cm/s)。适应结束后,采用流速递增法测定Ucrit,每间隔20 min,调节流速增加1 BL/s(体长/s),直至实验鱼游泳疲劳(疲劳的判定标准为:实验鱼被水流冲到游泳区后面筛网上不能游泳,停留20 s,则视其疲劳[19])。临界游泳速度采用公式:Ucrit=U1+(T1/T2)U2计算。式中,Ucrit为临界游泳速度(BL/s),U1为实验鱼所能完成游泳的最大速度(实验鱼疲劳前的速度,BL/s),速度增量U2=1 BL/s),T1为在最大速度下未能完成设定历时的实际持续时间(T1<20 min),时间间隔T2=20 min。
实验过程中每间隔10 min中测定一次水中溶解氧量。利用水泵进行内外水槽水的交换,使密封部分溶解氧不低于饱和溶解氧浓度的70%。耗氧率的计算公式:MO2=(St-Sb)×60 ×V/m,式中MO2为标准体重的运动代谢率[mg O2/(h·kg)];St为实验鱼存在时装置内溶解氧量随时间变化斜率的绝对值;Sb是无鱼时装置内溶解氧量随时间变化斜率的绝对值(细菌耗氧量);60为常数(min/h);V是密封部分水体积(L);m为鱼体重(kg)。耗氧代谢范围规定为实验中获得的最大耗氧率(MO2,Max)与最小耗氧率(MO2,Min)的差值。
鱼组织镉含量测定:将鲢幼鱼用丁香酚溶液(丁香酚溶液/乙醇=1/9,5 mL混合液溶入10 L水中)麻醉(5 min)后,解剖分离出鳃、肝脏、肌肉组织并于-40 ℃保存。之后,称取肝脏、鳃和肌肉组织,将各组织样本(以相同处理下12尾鱼为一个样本,分3组,对照组6尾鱼)称量(取湿重),放置于消解罐(50 mL)中消解[20],采用原子吸收分光光度计测定组织镉含量。
1.3 数据处理
实验数据在SPSS20.0中进行方差分析(ANOVA)和最小显著差数法(LSD)检验差异显著性,显著性水平为P<0.05。Pearson方法分析临界游泳速度、耗氧率与鳃、肌肉、肌肉组织镉含量相关性。统计数据表示为平均值±标准误(mean±SE)。
2 结果与分析
2.1 鲢幼鱼鳃、肝脏、肌肉组织镉累积量特征
采用静水急性毒性试验法测定镉暴露对鲢幼鱼的毒性,统计镉暴露24、48、72、96 h鲢幼鱼死亡率(图1),随镉暴露时间的延长和溶液浓度的增大鲢幼鱼的死亡率升高,采用直线内插法获得LC50分别为1.75、1.64、1.32、1.14 mg/L,镉安全浓度系数为0.1[21],计算鲢幼鱼镉的安全浓度为0.11 mg/L。与对照组比较,镉暴露组鲢幼鱼鳃(F=6.42;P<0.01)、肝脏(F=15.22;P=0.01)和肌肉(F=10.08;P<0.01)组织中镉累积量显著(图2)。镉浓度为0.73 mg/L时肝脏中镉累积量最大。镉在鲢幼鱼组织中的累积量:肝脏>鳃>肌肉。

图1 鲢幼鱼死亡率与水体铜含量和暴露时间的关系

图2 镉暴露后鲢幼鱼的鳃、肝脏、肌肉组织镉含量
a,b,c不同字母表示差异显著(P<0.05),下同。
2.2 镉暴露对鲢幼鱼临界游泳速度的影响
镉暴露对鲢幼鱼临界游泳速度的影响显著(F=48.88,P<0.05)(图3)。对照组、0.36、0.73、1.09和1.46 mg/L镉暴露组对应幼鱼临界游泳速度分别为(7.67±0.28) BL/s、(6.88±0.34) BL/s、(6.51±0.32) BL/s、(6.45±0.32) BL/s和(5.35±0.16) BL/s。随着镉浓度增加,鲢幼鱼相对临界游泳速度显著下降,暴露浓度为1.46 mg/L时,相对临界游泳速度为对照组的69.75%。

图3 镉暴露对鲢幼鱼临界游泳速度的影响
2.3 镉暴露对鲢幼鱼耗氧率的影响
镉暴露对鲢幼鱼代谢范围影响显著(F=48.88,P<0.05),随着暴露浓度的增加最大耗氧率的增加量先大于最小耗氧率的增加量,然后小于最小耗氧率的增加量,导致耗氧代谢范围呈先增加后减小趋势(图4)。0、0.36、0.73、1.09和1.46 mg/L镉暴露,对应鲢幼鱼耗氧代谢范围分别为(461.28±24.48)、(496.01±17.26)、(571.73±18.81)、(555.41±47.81)和(534.75±43.80) mg O2/(kg h)。镉浓度小于0.73 mg/L时,最小耗氧率和最大耗氧率与对照组之间没有差异。镉浓度为0.73 mg/L时,耗氧代谢范围最大,比对照组增加了23.94%。镉浓度大于0.73 mg/L时,耗氧代谢范围逐渐降低。

图4 镉暴露对鲢幼鱼最小耗氧率、最大耗氧率和耗氧代谢范围的影响
3 讨论
实验中测定了镉暴露后鲢幼鱼鳃、肝脏、肌肉组织中的镉累积量,并测定了鲢幼鱼游泳速度及耗氧率。不同浓度镉暴露,导致镉在鲢幼鱼组织中的累积量有差异,并对游泳速度和耗氧代谢率产生不同程度的影响。
3.1 镉暴露鲢幼鱼鳃、肝脏、肌肉组织镉累积量
重金属在鱼组织中的生物富集作用与暴露的浓度、鱼类自身的个体差异性、食性以及生存环境因素均有关系[22]。重金属通过体表渗透、鳃呼吸和摄食三种途径进入鱼体,其中鳃是重金属吸收的重要部位[23]。一般,镉含量在鱼体组织分布规律为肝脏>鳃>肌肉[24-25]。鳃为呼吸器官,血液含量丰富且与污染物直接接触,镉通过鳃顶端细胞膜上的钙离子通道,进入鳃组织细胞,从而快速累积。肝脏中金属硫蛋白、类金属硫蛋白和含氮杂环小分子化合物的基团和配体等对镉有很高的亲和力和络合能力,故镉累积量较高[26]。鲤的镉暴露实验表明,随着暴露时间的延长,暴露组的鳃、肝脏组织中镉累积量与对照组相比显著升高[27]。本研究中,镉暴露组鱼体镉累积量为肝脏大于鳃和肌肉中累积量,研究结果与文献报道类似。镉暴露后鳃和肝脏组织硫蛋白络合物的含量明显增加,致使多余的镉与金属硫蛋白结合,并排泄到体外[28],因此,不同浓度暴露组鲢幼鱼组织中镉累积量差异不显著。
3.2 镉暴露对鲢幼鱼游泳速度和耗氧代谢范围的影响
耗氧率是生物生理代谢的重要指标,常用作环境变化对生物影响的重要指标,对鱼类行为测定具有重要的意义[29]。低浓度镉暴露诱导产生的氧自由基和过氧化物,引发细胞膜脂质过氧化作用,对细胞造成伤害[30],导致泥鳅(Misgurnusanguillicaudatus)需要消耗大量氧气来维持受损机体的生理代谢[31]。急性镉暴露导致斑马鱼呼吸频率和呼吸强度先升高然后降低[32]。本研究获得相同的结果,急性镉暴露导致鲢幼鱼耗氧代谢范围先升高后降低,镉浓度为0.73 mg/L时,耗氧代谢范围为555.41±47.81 mg O2/(kg h)最大,比对照组显著要高。镉浓度大于0.73 mg/L时,耗氧代谢范围受到了抑制,逐渐减小。可能原因是低浓度镉暴露诱导刺激鳃膜等产生应激性反应,导致鲢幼鱼耗氧代谢作用增加。随着镉浓度的增加,导致鳃、内脏、肌肉等组织损伤,并表现为耗氧代谢降低。
相关性分析表明,临界游泳速度与鳃和肌肉组织中镉累积量呈显著的负相关,相关系数分别为-0.96 (P=0.01)和-0.90 (P=0.04),与肝脏组织中镉累积量相关性不显著-0.32 (P=0.60)。镉暴露会抑制鳃ATPase酶活性,并破坏鱼体内渗透压和离子平衡,影响鱼类的生理及代谢过程[33]。同时镉诱导氧自由基导致肌肉线粒体膜损伤,影响线粒体代谢,ATP合成量不足,导致肌丝的滑动受到一定的抑制,最终影响肌肉的收缩运动[34-35]。因此,镉在鳃和肌肉中浓度的增加,导致鲢幼鱼临界游泳速度降低。而且低浓度镉暴露引起鲢幼鱼体内乳酸含量增加,红细胞和血红蛋白数量降低[36],导致鲢幼鱼有氧运动能力降低,无氧运动能力增加,因此临界游泳速度降低。
3.3 镉暴露对鲢幼鱼的生态毒性
水体有毒物质对鱼类的毒性作用分为4个等级:安全浓度<0.1 mg/L,剧毒;安全浓度0.1~1.0 mg/L,高毒;安全浓度1~10 mg/L,中毒;安全浓度>10 mg/L,低毒[37];中国渔业水域水质标准规定水体镉含量应低于0.005 mg/L (GB11607-1989),对镉敏感物种急性安全浓度为0.032 mg/L[21]。本研究中,镉暴露对鲢幼鱼的安全浓度为0.11 mg/L,说明镉对鲢幼鱼为高毒物质,鲢幼鱼对镉暴露不敏感。但是与其他鱼类比较,镉暴露安全浓度,广东鲂(Megalobramaterminalis)为0.32 mg/L[25];唐鱼(Tanichthysalbonubes)为0.44 mg/L[38]食蚊鱼(Gambusiaaffinis)为2.26 mg/L[39],鲢幼鱼对镉暴露灵敏。急性镉暴露,镉浓度<0.73 mg/L时,最小耗氧率变化不显著,耗氧代谢范围表现为促进作用,而且临界游泳速度仅下降了16%,鲢幼鱼表现出了一定的耐受性。
4 结论
镉对鲢幼鱼为高毒物质,鲢幼鱼对镉暴露灵敏度高。镉暴露后鲢幼鱼组织内的镉累积量不同,肝脏>鳃>肌肉。镉暴露导致鲢幼鱼耗氧代谢范围先增加后降低,可能是低浓度镉暴露诱导鳃等产生应激性,消耗大量氧气来维持受损机体的生理代谢。耗氧量增加,游泳过程中耗氧效率降低,游泳能力降低。而且鳃和肌肉组织损伤,引起红细胞和血红蛋白数量降低和乳酸含量增加,导致鲢幼鱼有氧运动能力降低,临界游泳速度也会降低。鱼对环境的适应性表现为各种稳态机制和补偿机制,污染条件下鱼类运动能力调节与相关酶活性变化之间的关系,鱼类对重金属污染环境下的适应阈值,环境的理化因素和污染物之间的相互作用对鱼类不同年龄时期行为及代谢的影响等的研究,在实际应用中更具有实际意义,有待进一步研究。
[1]Idriss A A,Ahmad A K.Heavy Metal Concentrations in Fishes from Juru River,Estimation of the Health Risk[J].Bull Environ Contamin Toxicol,2015,94(2):204-208.
[2]曾乐意,闫玉莲,谢小军.长江朱杨江段几种鱼类体内重金属铅、镉和铬含量的研究[J].淡水渔业,2012,42(2):61-65.
[3]Barwick M,Maher W.Biotransference and biomagnification of selenium copper,cadmium,zinc,arsenic and lead in a temperate seagrass ecosystem from lake macquarie estuary,NSW,Australia[J].Mar Environ Res,2003,56(4):471-502.
[4]Okocha R C,Adedeji O B.Overview of cadmium toxicity in fish[J].J Appl Sci Res,2011,7(7):1195-1207.
[5]Burcu Y,Cahit E.Cadmium accumulation in gill,liver,kidney and muscle tissues of common carp,Cyprinuscarpio,and nile tilapia,Oreochromisniloticus[J].Bul Environ Contamin Toxicol,2014,92(5):546-550.
[6]Costa P M,Chicano-Gálvez E,Barea J L,et al.Alterations to proteome and tissue recovery responses in fish liver caused by a short-term combination treatment with cadmium and benzo[a]pyrene[J].Environ Poll,2010,158(10):3338-3346.
[7]Ferencz A,Juhász R,Butnariu M,et al.Expression analysis of heat shock genes in the skin,spleen and blood of common carp (Cyprinuscarpio) after cadmium exposure and hypothermia[J].Acta Biol Hungarica,2012,63(1):15-25.
[8]Liu L L,Li C M,Zhang Z W,et al.Protective Effects of selenium on cadmium-induced brain damage in chickens[J].Biol Trac Elem Res,2014,158(2):176-185.
[9]韩 杰,许人骥,于慧慧,等.镉对鲤遗传毒性和外周血细胞数量的影响[J].淡水渔业,2010,40(1):16-20.
[10]王文义.三峡库区蓄水前重庆段鱼类中重金属含量水平调查[J].水资源保护,2008,24(5):34-37.
[11]张 晟,黎莉莉,张 勇,等.三峡水库135m水位蓄水前后水体中重金属分布变化[J].安徽农业科学,2007,35(11):3342-3343.
[12]Fu S J,Cao Z D,Yan G J,et al.Integrating environmental variation,predation pressure,phenotypic plasticity and locomotor performance[J].Oecologia,2013,173(2):343-354.
[13]Farrell A P.Comparisons of swimming performance in rainbow trout using constant acceleration and critical swimming speed tests[J].Int J Quant Chem,2008,72(3):693-710.
[15]Wolter C,Arlinghaus R.Navigation impacts on freshwater fish assemblages:the ecological relevance of swimming performance[J].Rev Fish Biol Fish,2003,13(1):63-89.
[16]Cunningham J L,Mcgeer J C.The effects of chronic cadmium exposure on repeat swimming performance and anaerobic metabolism in brown trout (Salmotrutta) and lake whitefish (Coregonusclupeaformis)[J].Aquat Toxicol,2015,173:9-18.
[17]Couture P,Kumar P R.Impairment of metabolic capacities in copper and cadmium contaminated wild yellow perch (Percaflavescens)[J].Aquatic Toxicol,2003,64(1):107-120.
[18]Tu Z,Li L,Yuan X,et al.Aerobic swimming performance of juvenile Largemouth bronze gudgeon (Coreiusguichenoti) in the Yangtze River[J].J Exp Zool Part A,2012,317(5):294-302.
[19]Lee C G,Farrell A P,Lotto A,et al.The effect of temperature on swimming performance and oxygen consumption in adult sockeye (Oncorhynchusnerka) and coho (O.kisutch) salmon stocks[J].J Exp Biol,2003,206(18):3239-3251.
[20]Xu T,Huang Y P,Chen J.Metal distribution in the tissues of two benthic fish from paddy fields in the middle reach of the Yangtze River[J].Bull Environ Contamin Toxicol,2014,92(4):446-450.
[21]吴丰昌,孟 伟,曹宇静,等.镉的淡水水生生物水质基准研究[J].环境科学研究,2011,24(2):172-184.
[22]Pourang N.Heavy metal bioaccumulation in different tissues of two fish species with regards to their feeding habits and trophic levels[J].Environ Monit Assessm,1995,35(3):207-219.
[24]Tunçsoy M,Erdem C.Accumulation of copper,zinc and cadmium in liver,gill and muscle tissues ofOreochromisniloticusexposed to these metals separately and in mixture[J].Fresen Environ Bull,2014,23(5):1143-1149.
[25]曾艳艺,赖子尼,杨婉玲,等.铜和镉对珠江天然仔鱼和幼鱼的毒性效应及其潜在生态风险[J].生态毒理学报,2014,9(1):49-55.
[26]王桂燕,胡筱敏,周启星,等.镉对草鱼的急性毒性效应及SOD的影响[J].东北大学学报:自然科学版,2007,28(12):1758-1761.
[27]侯晓莹,吴 萍,祝溢锴,等.镉在鲤鱼组织内的蓄积及对血浆指标的影响[J].生态毒理学报,2011,6(6):667-672.
[28]Ghedira J,Jebali J,Bouraoui Z,et al.Metallothionein and metal levels in liver,gills and kidney ofSparusaurataexposed to sublethal doses of cadmium and copper[J].Fish Physiol Biochem,2010,36(1):101-107.
[29]Binning S A,Roche D G,Layton C.Ectoparasites increase swimming costs in a coral reef fish[J].Biology Letters,2013,9(1):323-326.
[30]孙淑红,焦传珍,刘小林,等.Cd(II)对泥鳅抗氧化酶活性和脂质过氧化的影响[J].大连海洋大学学报,2009,24(1):52-56.
[31]贾秀英.四种重金属对泥鳅幼鱼呼吸强度的影响[J].浙江大学学报:农业与生命科学版,2001,27(5):556-558.
[32]汪红军,李嗣新,周连凤,等.5种重金属暴露对斑马鱼呼吸运动的影响[J].农业环境科学学报,2010,29(9):1675-1680.
[33]Torre F R D L,Salibián A,Ferrari L.Biomarkers assessment in juvenileCyprinuscarpio,exposed to waterborne cadmium[J].Environ Pollut,2000,109(2):277-82.
[34]Chen,T H,Gross,J A,Karasov,W H.Sublethal effects of lead on northern leopard frog (Ranapipiens) tadpoles[J].Environ Toxicol Chem,2006,25(5):1383-1389.
[35]柏世军,许梓荣.镉对罗非鱼鳃线粒体结构和能量代谢的影响[J].环境科学,2007,28(1):160-164.
[36]张 婷,张 玉,李德亮,等.鲢鱼对环境镉胁迫的生理响应及其对湘江鱼类增殖放流的启示[J].中国科学:生命科学,2013,5(43):432-439.
[37]张志杰,张维平.环境污染生物监测与评价[M].北京:中国环境科学出版社,1991:69.
[38]王瑞龙,马广智,方展强.铜、镉、锌对唐鱼的急性毒性及安全浓度评价[J].水产科学,2006,25(3):117-120.
[39]刘 阳,陈 曦,覃剑晖.镉对食蚊鱼(Gambusiaaffinis)的急性毒性效应[J].安全与环境学报,2015(3):362-366.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

