论文:饲料蛋白能量比对草鱼幼鱼生长性能、蛋白利用和体成分的影响

饲料蛋白能量比对草鱼幼鱼生长性能、蛋白利用和体成分的影响
田娟1,2,高攀3,蒋明1,2,文华1,吴凡1,刘伟1,杨长庚1,喻丽娟1
(1.中国水产科学研究院长江水产研究所,农业部淡水生物多样性保护与利用重点开放实验室,武汉430223;2.淡水水产健康养殖湖北省协同创新中心,武汉430070;3.新疆维吾尔自治区水产科学研究所,乌鲁木齐830000)
摘要:以鱼粉和豆粕为蛋白源,鱼油和豆油等比例混合油为脂肪源,采用4× 4因子实验来确定草鱼(Ctenopharyngodon idellus)幼鱼饲料中的合适蛋白能量比(P/E),其中饲料蛋白水平分别为20%、25%、30%、35%,能量水平为12.5、13.7、15、16.2 kJ/g,饲料蛋白能量比的范围为12.1~27.3 mg/kJ,共16组饲料,每组设3个重复,连续投喂初体质量(16.85±0.29)g的草鱼幼鱼10周,研究饲料蛋白能量比对草鱼幼鱼生长性能、蛋白利用和体成分的影响。结果表明:(1)最高末体质量和特定生长率出现在P/E为 18.3 mg/kJ组,而P/E 为16.0 mg/kJ组的饲料系数最高,蛋白质效率和蛋白沉积率最高组分别为P/E 12.10 mg/kJ组和15.20 mg/kJ组。(2)P/E为27.30 mg/kJ组的能量沉积率和总氮排泄率最大。(3)在同一饲料蛋白水平下,鱼体的脂肪含量随饲料能量水平升高而升高;在同一饲料能量水平下,鱼体的蛋白含量随饲料蛋白含量升高而升高。对生长、蛋白利用、体成分的实验结果进行综合分析,草鱼幼鱼饲料的最适蛋白含量为30%,最适P/E 为19.5 mg/kJ。
关键词:草鱼(Ctenopharyngodon idellus);蛋白能量比;生长;体成分;总氮排泄率
动物从外界摄取营养物质的第一目的是为了供给生命活动的能量需要,水产动物因优先利用蛋白质为能量来源,特别是当饲料中可消化能含量低时,饲料蛋白质更多的被当作能源消耗,从而影响了饲料利用率与水产动物生长,因此适宜饲料能量蛋白比是营养研究的重要内容[1]。饲料中蛋白质和能量水平及其比例影响着鱼类的摄食、生长、营养物质的转化效率和鱼体组成成分等[2-7]。现有的研究结果表明,饲料中适宜的蛋白能量比(P/E)可提高饲料蛋白质在鱼体内的沉积率,并可通过提高非蛋白物质的供能作用从而节约蛋白质[8]。在花鲈(Lateolabraxjaponicus)中发现,当饲料脂肪含量从8%上升到12%,而蛋白质从46%下降到41%时,鱼体特定生长率、蛋白质沉积率和蛋白质效率均显著提高[9]。同时适宜的饲料P/E可降低氮的排放量,减少由于投喂饲料造成的水环境污染。在鲤科鱼类中发现,饲料中脂肪含量升高会降低肝胰腺中氨基酸降解酶的分泌,从而导致蛋白质净利用率增加和氮排泄量减少[10]。适当提高饲料中可消化非蛋白物质的比例,澳洲鳗鲡(Anguillaaustralisaustralis)通过降低氮的损失而提高氮的储存率[11]。然而,过高水平的蛋白质或能量对鱼体亦会造成不利影响,当饲料蛋白质含量满足鱼体生长需求后,过高的蛋白质限制了鱼体对其他营养素的消化吸收,从而导致生长缓慢和养殖成本增加[9]。同时饲料中过多的非蛋白能源物质会影响鱼类的摄食和生长,导致鱼体脂肪肝发生和饲料系数升高[12-14]。
草鱼(Ctentpharyngodonidellus)属鲤形目鲤科雅罗鱼亚科草鱼属的惟一种,是我国淡水养殖鱼类的第一大品种。目前对草鱼研究表明,以生长为评价指标0.75 g仔稚鱼的适宜P/E为23.47 mg/kJ[15],以消化酶为评价指标草鱼幼鱼的适宜P/E为21.7 mg/kJ[16]。但对不同蛋白能量比饲料对草鱼蛋白质利用效率,以及氮排放的影响未见报道,因此本实验综合研究草鱼饲料的最佳P/E,为草鱼养殖对环境的影响以及草鱼饲料配制提供参考依据。
1材料与方法
1.1实验设计与饲料
实验基础饲料以鱼粉、豆粕为蛋白源(添加质量比为3.25∶1),以大豆油和鱼油(1∶1)为脂肪源,以糊精为糖源,以微晶纤维素粉为调节物质,采用4×4因子实验法设计粗了蛋白含量分别为20%、25%、30%、35%,能量水平为12.5、13.7、15、16.2 kJ/g的16种半纯化饲料,实验基础饲料配方见表1,饲料总能根据粗蛋白、脂肪、碳水化合物的平均总产热量分别为16.9、37.6、16.7 kJ/g推算而得。各种饲料原料均按配比精确称量,粉碎后过40目分析筛,逐级混合搅拌均匀,用绞肉机制成直径为2 mm、长约4 mm的圆柱形颗粒,采用自然风干,选取颗粒大小适宜的饲料用胶袋密封,置于-20 ℃冰箱中保存备用。
1.2实验鱼及饲养条件
实验用草鱼取自长江水产研究所苗种繁育场。正式实验开始前用第1组饲料驯养2周,使其适应实验环境及实验饲料。正式实验时,鱼体饥饿24 h后,选取体质健壮、规格整齐,初始体质量为(16.85±0.29) g的实验鱼960尾,随机分为16组,每组设3重复,每重复20尾,饲养于250 L塑料养殖桶。养殖实验持续10周,每天投喂3次(8:30、12:30和16:30各1次),采用表观饱食投喂法,根据鱼体生长摄食情况和水温等环境状况及时调整投饲量,投饲率为鱼体质量的3%~5%。每日记录水温、草鱼摄食行为和死亡数量等,每两天通过虹吸清理桶中污物,桶内连续通气并保持常流水,养殖所用水为经过沙滤的湖水,水交换速率40~50 L/h,自然光照,养殖期间水温23~29 ℃(自然水温),溶氧大于5 mg/L,pH (7.5±0.1),NH4+-N和NO2--N分别为(0.5±0.13) mg/L和(0.029±0.016)mg /L。
1.3生长性能和全鱼体成分的测定
饲养实验结束后,停食24 h后对每个养殖桶内鱼进行称重,计算其特定生长率、摄食率和饲料系数,取5尾草鱼幼鱼测其体长、体重,计算其肥满度,然后进行全鱼生化成分分析,全鱼样品中水分含量采用 105 ℃恒温干燥失重法(GB/T5009.3)、粗蛋白采用凯氏定氮法(GB/T5009.5)、粗脂肪采用索氏抽提法(GB/T5009.6)、粗灰分采用灼烧称重法(GB/T5009.4)测定。

表1 实验饲料配方及化学组成
注:维生素预混料(IU或mg/kg基础饲料):维生素A 4500 IU,维生素D 1000 IU,维生素E 100 mg,维生素K35 mg,维生素B110 mg,维生素B220 mg,维生素B610 mg,烟酸 150 mg,维生素C 400 mg,泛酸钙 100 mg,叶酸5 mg,生物素 1 mg,肌醇 500 mg,维生素B120.05 mg;无机盐预混料采用荻野珍吉配方[17]。
摄食率(FR)=Wf/[(Wt+W0)/2×t] ;特定生长率(SGR)=100%×(LnWt-LnW0) /t;
饲料系数(FCR)=(Wt-W0)/Wf;蛋白质效率(PER) =(Wt-W0)/(Wf×Pf) ;
蛋白质沉积率 (PRV) =(Wt×Pt-W0×P0)/(Wf×Pf) ;
能量沉积率 (ERV) =(Wt×Et-W0×E0)/(Wf×Ef) ;肥满度(CR)=100×Wt/L3;
其中,W0、Wt、Wf分别为初始鱼体重(g)、终末鱼体重和投喂饲料重(g);P0、Pt、Pf分别为初始鱼、终末鱼和饲料的蛋白含量(g);E0、Et、Ef分别为初始鱼、终末鱼和饲料的能量含量(kJ/g);L为终末鱼体长(cm);t为实验天数;
1.4总氮排泄率的测定
饲养42 d后,每实验桶各取3尾鱼进行总氮排泄率的测定。将实验鱼放入自制代谢桶(50 L)中,桶中装有20 L经充分曝气的养殖水,在代谢桶中养殖7 d后,待鱼体体征稳定并主动摄食后,开始氮排泄率的测定。具体操作:准确称取3%鱼体重的饲料,另设一无鱼代谢桶作为对照。保持水温(25±0.5)℃。在投喂饲料24 h后测定水体中总氮含量。总氮采用碱性过硫酸钾消解紫外分光光度法(GB11894-89)测定,排泄率用每kg鱼体重单位时间的排泄量表示(mg/(kg·h))。
1.5数据处理
所有结果均以平均值±标准差来表示。采用STATISTIC 6.0统计软件进行统计分析,在双因素方差分析的基础上,并用Duncan氏均值多重比较对实验数据进行分析,P﹤0.05即认为有显著性差异。
2结果与分析
2.1蛋白能量比对草鱼幼鱼生长性能和饲料利用率的影响
由表2可知,蛋白水平和能量水平对草鱼的生长性能均有显著影响,并且对末体质量、特定生长率和饲料系数存在交互作用。最高末体质量和特定生长率出现在第12组(蛋白含量30%、总能水平16.3 kJ/g、蛋能比18.3 mg/kJ)。第1组(蛋白含量20%、总能水平12.5 kJ/g、蛋能比16.0 mg/kJ)饲料系数最高。在总能为12.5 kJ/g时,当饲料蛋白质含量由20%升高到35%,鱼体的末体质量和特定生长率逐步升高,摄食率和饲料系数逐步降低;在总能为13.7、15和16.3 kJ/g时,各组也
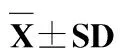
表2 不同蛋白能量比饲料对草鱼幼鱼的摄食率、特定生长率、饲料系数和肥满度的影响
注:同一列数值上标字母没有相同者表示差异显著(P<0.05),下表同.
表现出高蛋白组生长性能优于低蛋白组。在蛋白水平20%和25%时,特定生长率随总能水平的升高呈现上升的趋势,摄食率和饲料系数逐步下降;在蛋白水平为30%和35%时,能量水平对特定生长率、摄食率和饲料系数没有显著影响。饲料蛋白能量比对草鱼肥满度无显著影响。
2.2蛋白能量比对草鱼蛋白质效率、蛋白质沉积率、能量沉积率和总氮排泄率的影响
从表3可以看出,饲料蛋白和能量水平对草鱼蛋白质效率、蛋白质沉积率、能量沉积率和总氮排泄率均有显著影响,且存在交互作用。第4组(蛋白含量20%、总能16.4 kJ/g、蛋能比12.20 mg/kJ)蛋白质效率最高,第8组(蛋白25%、总能16.3 kJ/g,蛋能比15.20 mg/kJ)蛋白质沉积率最高;第13组(蛋白含量35%、总能12.6 kJ/g、蛋能比27.30 mg/kJ)能量沉积率和总氮排泄率最大。
在饲料蛋白含量为20%和25%时,在同一饲料蛋白水平下,随总能水平升高蛋白质效率和沉积率逐渐升高,能量沉积率无显著变化,总氮排泄率逐渐下降。在蛋白含量为30%时,第10、11和12组的蛋白质效率和沉积率无显著性差异,但均大于第9组;而总能水平对能量沉积率和总氮排泄率无显著影响。在蛋白含量为35%时,饲料能量水平对蛋白质效率和沉积率无显著影响,能量沉积率和总氮排泄率以第13组最高,显著高于第15组和16组。
在总能水平为12.5和13.7 kJ/g时,蛋白质效率随饲料蛋白含量的升高而显著降低(P<0.05),能量沉积率和总氮排泄率逐步升高,但对蛋白质沉积率无显著影响。在总能水平为15.和16.3 kJ/g时,蛋白质效率随蛋白水平升高逐渐下降,能量沉积率逐步升高;蛋白含量20%、25%和30%组的蛋白沉积率无显著差异,但均显著高于35% 组;蛋白含量25%、30%和35%时的总氮排泄率无显著性差异,但显著高于20% 组。
2.3不同蛋白能量比对幼鱼全鱼体成分的影响
从表4中可知,饲料蛋白水平对全鱼体成分有显著影响,能量水平仅对草鱼全鱼水分和粗脂肪含量有显著影响,但两者不存在交互作用。
在饲料蛋白水平相同下,随着饲料中总能水平的上升,全鱼的粗脂肪含量显著性升高,粗蛋白含量没有显著变化,灰分和水分含量在蛋白含量20%时有显著差异,其余各组也无显著变化。
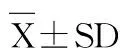
表3 不同蛋白能量比饲料对草鱼幼鱼的蛋白质效率、蛋白质沉积率、能量沉积率和总氮排泄率的影响
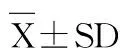
表4 不同蛋白能量比饲料对草鱼幼鱼全鱼体成分的影响
能量水平为12.5 kJ/g时,随饲料蛋白含量的升高,各组蛋白质和灰分含量显著上升;粗脂肪含量有上升的趋势,但无显著差异;水分含量呈下降的趋势。饲料能量为13.7 kJ/g时,各组蛋白质、粗脂肪和灰分含量随饲料蛋白含量的上升而升高,但第10组和第14组的全鱼粗蛋白和粗脂肪含量无显著差异,水分含量呈下降趋势;能量为15 kJ/g的各组全鱼粗蛋白和粗脂肪水平随饲料蛋白水平显著升高,但对灰分无显著影响;能量为16.3 kJ/g的各组除第16组外,全鱼粗蛋白和粗脂肪含量均是逐步的升高,灰分和水分含量无显著差异。
3讨论
3.1饲料蛋白能量比对草鱼幼鱼生长性能的影响
饲料中蛋白质和能量对鱼类正常生长发育起着非常重要的作用,鱼类的生长和体内营养物质的增加需要消耗大量的能量和蛋白质,蛋白质和能量水平及其比例影响着鱼类的摄食、生长、营养物质的转化效率和鱼体组成成分等[18]。鉴于当前优质蛋白源紧缺,因此本实验对初始体重为(16.85±0.29) g草鱼,设计了蛋白水平为20%~35%,能量水平为12.5~16.3 kJ/g的4×4因子实验,共计16组饲料,以期通过提高脂肪或碳水化合物等非蛋白物质的供能作用来降低蛋白质作为草鱼能源的消耗量。本实验结果表明,在饲料能量水平一定时,随饲料中蛋白质含量的提高,草鱼幼鱼的特定生长率逐渐升高,摄食率和饲料系数呈逐渐下降的趋势;而在饲料蛋白含量一定的情况下,随着能量水平的升高,蛋白含量20%和25%两组的特定生长率逐步升高,摄食率和饲料系数逐步下降,但当蛋白含量为30%和35%时,能量的变化对特定生长率、摄食率和饲料系数的影响不显著。以生长性能为评价指标,分析得出当饲料中蛋白含量为30%,能量为15.2 kJ/g,蛋白能量比为19.5 mg/kJ时,即第11组获得较优生长性能。早前对初始体重为0.75 g的草鱼进行研究发现其最适蛋白水平为25%,可消化能量约为8 833 kJ/kg,最适蛋白能量比23.47 mg/kJ[15],根据其配方进行推算其最适总能约为12 kJ/g,其实验结果均低于本实验结果,并且其生长性能如特定生长率和蛋白质效率均较低,而饲料系数为本实验的数倍,因此认为今后有必要对草鱼不同生长阶段的蛋白能量比进行更精准的实验设计。而在其他鱼种上发现,鲈鱼幼鱼为25.9 mg/kJ[9],罗非鱼亲鱼(Oreochromisniloticus)[19]和黑鲶(Rhamdiaquelen)仔稚鱼[20]均为23.6 mg/kJ。这进一步表明鱼类的蛋白能量比与鱼体的规格和鱼种类紧密相关,对同一品种需要分生长阶段进行研究。
饲料中适宜的蛋白能量比往往是通过合理使用非蛋白能量物质—脂肪或糖类来供能,从而来降低蛋白原料的配比。Ai等[9]研究发现花鲈幼鱼饲料蛋白含量41%、脂肪含量12%组的特定生长率高于饲料蛋白46%、脂肪8%组,蛋白质沉积率和蛋白质效率前者亦高于后者;当石斑鱼(Epinephelusmalabaricus)饲料的能量含量在14.28~15.75 kJ/g时,蛋白含量可从50%降到44%时,生长性能无显著差异[7];在黄颡鱼(Pseudobagrusfulvidraco)中发现蛋白含量42%、脂肪含量19%的实验组和蛋白含量52%、脂肪含量10%的实验组生长无显著差异[21]。在本实验结果显示,第8组(粗蛋白、粗脂肪和碳水化合物水平分别为24.8%、14.8%和38.7%)和第13组(对应为35.1%、4.7%和28.7%)饲料系数和特定生长率并没有显著差异,这表明在一定范围内草鱼幼鱼可较好利用脂肪和碳水化合物来供能,来降低对蛋白质的需要量,而达到类似的生长效果。
3.2饲料蛋白能量比对草鱼蛋白利用的影响
适量的非蛋白能量物质—脂肪或碳水化合物代替蛋白质不仅可以用来供能,还可以提高蛋白质的利用率,降低氮的排放量,减少由于投喂饲料造成的水环境的污染。Engin等[11]在研究中发现,当提高饲料中可消化非蛋白原料的含量,鱼体可以通过降低氮的损失而提高氮的储存率。在鲤科鱼类也发现,饲料中脂肪含量升高会降低肝胰腺中氨基酸分解酶的分泌,从而导致蛋白质净利用率的增加和氮排泄量的减少[22]。用脂肪、碳水化合物使饲料的可消化能达到15.96 kJ/g以上,鲤(Cyprinuscarpio)的含氮排泄物显著减少[23]。在胭脂鱼(Myxocyprinusasiaticus)上发现,蛋白含量39%、脂肪含量14%组的蛋白质效率、蛋白质沉积率、能量沉积率与蛋白含量44%、脂肪含量14%组无显著差异[4]。本实验结果表明,在同一能量水平下,随着饲料蛋白含量的升高,鱼体蛋白质效率和蛋白质沉积率并无显著差异。这说明低蛋白含量饲料组中蛋白质被草鱼幼鱼有效地用于鱼体蛋白的合成,而在高蛋白含量饲料中过高的蛋白质并没有完全用于生长。但在同一蛋白水平下,随着脂肪含量的升高,蛋白质效率和蛋白质沉积率升高,总氮排泄率下降,这说明在适宜范围内,非蛋白源供能可有效降低氮排泄增加氮沉积。综合生长性能指标,发现在第11组即蛋白含量为30%、总能为15.0 kJ/g时,蛋白质效率、蛋白质沉积率和总氮排泄率均较优,因此本实验认为草鱼适宜的蛋白能量比为19.5 mg/kJ。
3.3饲料的蛋白能量比对草鱼幼鱼体成分的影响
饲料蛋白能量比对鱼体成分的影响已有不少报道,对胡子鲶(Ictaluruspunctatus)[24]、红姑鱼(Sciaenopsocellatus)[25]的研究结果表明,饲料中蛋白含量并不影响鱼体蛋白含量;对克林雷氏鲶(Rhamdiaquelen)[20]、尼罗罗非鱼(Oreochromisniloticus)[26]的研究发现,高蛋白饲料在一定程度上可以提高全鱼粗蛋白含量。本实验中在同一能量水平下,随饲料蛋白含量的升高,全鱼粗蛋白含量也升高,但蛋白沉积率并没有随之升高。这表明饲料中蛋白水平会影响草鱼的营养价值,但是其蛋白作为能量消耗的比例增大。在同一低蛋白水平下(20%和25%),随着饲料能量水平的升高,鱼体脂肪含量和粗蛋白含量均呈逐渐升高的趋势,这与花鲈[9]、黑鲷(Sparusmacrocephalus)[27]、黄颡鱼[21]的研究结果相一致。但在同一饲料高蛋白水平下(35%),各组全鱼粗蛋白含量、蛋白沉积率并未因饲料能量水平的升高而出现显著性变化,这可能是因为脂肪节约蛋白质的本质仅限于当鱼体摄入的蛋白质不够时,鱼体尽量降低蛋白质供能,而使更多的蛋白质行使其他脂肪无法替代的功能;当鱼体摄入的蛋白足够充分时,草鱼依然优先以蛋白质为能源。因此草鱼幼鱼饲料中含过高蛋白质是对蛋白原料的浪费,适量添加其他能源物质可以起到节约蛋白质的作用。
4结论
饲料中适宜的蛋白能量比可以促进草鱼的生长,增加蛋白沉积,降低氨氮排泄率。草鱼幼鱼饲料中添加过高的蛋白原料并不能促进生长与蛋白沉积,适量添加其他能源物质可以起到节约蛋白质的作用。由生长、蛋白利用、体成分的实验结果综合分析,草鱼幼鱼饲料的最适蛋白含量为30%,最适P/E 19.5 mg/kJ。
参考文献:
[1]李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996:44-82.
[2]Guo Z Q,Zhu X M,Liu J S,et al.Effects of dietary protein level on growth performance,nitrogen and energy budget of juvenile hybrid sturgeon,Acipenserbaerii♀×A.gueldenstaedtii♂[J].Aquaculture,2012,338-341:89-95.
[3]Helland S J,Hatlen B,Grisdale-Helland B.Energy,protein and amino acid requirements for maintenance and efficiency of utilization for growth of Atlantic salmon post-smolts determined using increasing ration levels[J].Aquaculture,2010,305(1-4):150-158.
[4]Yuan Y C,Gong S Y,Luo Z,et al.Effects of dietary protein to energy ratios on growth and body composition of juvenile Chinese sucker,Myxocyprinusasiaticus[J].Aquacult Nutr,2010,16(2):205-212.
[5]Morais S,Bell J G,Robertson D A,et al.Protein/lipid ratios in extruded diets for Atlantic cod (GadusmorhuaL.):Effects on growth,feed utilisation,muscle composition and liver histology[J].Aquaculture,2001,203(1-2):101-119.
[6]Wang Y,Guo J L,Li K,et al.Effects of dietary protein and energy levels on growth,feed utilization and body composition of cuneate drum (Nibeamiichthioides)[J].Aquaculture,2006,252(2-4):421-428.
[7]Shiau S Y,Lan C W.Optimum dietary protein level and protein to energy ratio for growth of grouper (Epinephelusmalabaricus)[J].Aquaculture,1996,145(1-4):259-266.
[8]Nankervis L,Matthews S J,Appleford P.Effect of dietary non-protein energy source on growth,nutrient retention and circulating insulin-like growth factor I and triiodothyronine levels in juvenile barramundi,Latescalcarifer[J].Aquaculture,2000,191(4):323-335.
[9]Ai Q H,Mai K S,Li H T,et al.Effects of dietary protein to energy ratios on growth and body composition of juvenile Japanese seabass,Lateolabraxjaponicus[J].Aquaculture,2004,230(1-4):507-516.
[10]Shimeno S,Shikata T,Hosokawa H,et al.Metabolic response to feeding rates in common carp,Cyprinuscarpio[J].Aquaculture,1997,151(1-4):371-377.
[11]Engin K,Carter C G.Ammonia and urea excretion rates of juvenile Australian short-finned eel (Anguillaaustralisaustralis) as influenced by dietary protein level[J].Aquaculture,2001,194(1-2):123-136.
[12]Liu B,Xie J,Ge X P,et al.Effect of high dietary carbohydrate on growth,serum physiological response,and hepatic heat shock cognate protein 70 expression of the top-mouth culterErythroculterilishaeformisBleeker[J].Fish Sci,2012,78(3):613-623.
[13]Hatlen B,Grisdale-Helland B,Helland S J.Growth,feed utilization and body composition in two size groups of Atlantic halibut (Hippoglossushippoglossus) fed diets differing in protein and carbohydrate content[J].Aquaculture,2005,249(1-4):401-408.
[14]Du Z Y,Liu Y J,Tian L X,et al.Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp (Ctenopharyngodonidella)[J].Aquacult Nutr,2005,11(2):139-146.
[15]蒋湘辉,刘刚,金广海,等.饲料蛋白质和能量水平对草鱼生长和鱼体组成的影响[J].水产学杂志,2010,23(1):24-27.
[16]高攀,蒋明,文华,等.不同蛋白能量比饲料对草鱼幼鱼消化酶活性的影响[J].淡水渔业,2009,39(6):54-58.
[17]获野珍吉.鱼类的营养和饲料[M].陈国铭,黄小秋,译.北京:海洋出版社,1987:325-326.
[18]赵世亮.水产动物营养与饲料研究进展[J].畜牧与饲料科学,2010,31(5):53-54.
[19]El-Sayed A F M,Kawanna M.Effects of dietary protein and energy levels on spawning performance of Nile tilapia (Oreochromisniloticus) broodstock in a recycling system[J].Aquaculture,2008,280(1-4):179-184.
[20]Salhi M,Bessonart M,Chediak G,et al.Growth,feed utilization and body composition of black catfish,Rhamdiaquelen,fry fed diets containing different protein and energy levels[J].Aquaculture,2004,231(1-4):435-444.
[21]Kim L O,Lee S M.Effects of the dietary protein and lipid levels on growth and body composition of bagrid catfish,Pseudobagrusfulvidraco[J].Aquaculture,2005,243(1-4):323-329.
[22]Shimeno S,Kheyyali D,Shikata T.Metabolic response to dietary lipid to protein ratios in common carp[J].Fish Sci,1995,6l(6):977-980.
[23]刘恩生.日本利用碳水化合物和高能低蛋白饵料养鲤鱼的动向[J].饲料研究,1994,(2):32-33.
[24]Page J W,Andrews J W.Interaction of dietary levels of protein and energy on channel catfish (Ictaluruspunctatus)[J].J Nutr,1973,103(3):1339-1346.
[25]刘永坚,刘栋辉,田丽霞,等.饲料蛋白质和能量水平对红姑鱼生长和鱼体组成的影响[J].水产学报,2002,26(3):242-246.
[26]胡国成,李思发,何学军,等.不同饲料蛋白质水平对吉富品系尼罗罗非鱼幼鱼生长和鱼体组成的影响[J].饲料工业,2006,27(6):24-27.
[27]彭士明,陈立侨,叶金云,等.饵料蛋白能量比对黑鲷幼鱼生长和体成分的影响[J].中国水产科学,2005,12(4):465-470.
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊",将会定期向你推送信息!

