斑马鱼早期卵子发生的分析方法
摘要:
卵母细胞分化是一个高度动态和复杂的发育过程,其机制理解促进了女性生殖、生育和卵巢癌生物学。尽管斑马鱼模型具有许多特性,但它尚未完全用于研究早期卵母细胞分化和卵巢发育。部分原因是成年斑马鱼卵巢的特性使得获取早期卵母细胞在技术上具有挑战性。为了克服这些技术障碍,我们利用了斑马鱼幼鱼的卵巢,在那里早期卵母细胞可以容易地大量发现并以可预测的方式进展。我们对卵母细胞分化和卵巢发育的早期阶段进行了描述,并确定了准确的分期标准。我们进一步发展了定量显微镜、实时成像技术、卵巢培养和卵母细胞的阶段性分离用于生化分析。这些方法最近为我们提供了关于早期卵子发生的史无前例的观点,使我们能够研究Balbiani体的形成,尽管Bb具有巨大的发展意义,但是它很少被研究,并且它是如何形成的,两个多世纪以来在任何物种中都是未知的。我们能够追踪Balbiani体的形成和卵母细胞对称性断裂到减数分裂的开始。本研究揭示了卵母细胞新的细胞骨架结构,以及特化的细胞组织对分化的贡献。总的来说,幼年斑马鱼卵巢是细胞和发育生物学研究的一个令人兴奋的模型。我们描述了斑马鱼身上开发的卵巢研究的方案,包括所有实验步骤,这些步骤将允许其他斑马鱼重复这种分析。
简介:
虽然早期卵子发生已经在果蝇中被广泛地描述,但是其卵子发生和卵巢发育的模式并不代表脊椎动物,尽管有些方面是保守的。在小鼠中,对卵子发生的一般进展进行了表征,并研究了许多破坏卵子发生的突变基因。斑马鱼尚未完全用于卵子发生的研究,部分原因是缺乏分子和形态学特征以及缺乏足够的分析工具。三维(3D)高分辨率细胞视图是发育过程的形态学和细胞分化特征全面分析的关键。成年斑马鱼卵巢对早期卵母细胞的这种分析提出了挑战,早期卵母细胞非常小。成年斑马鱼卵巢形态学上厚而呈小叶状,含有多期卵母细胞的非同步混合。许多是晚期卵母细胞,非常大(直径为200~730μm),不透明。早期卵母细胞非常小(8~30μm),透明。这为早期卵母细胞的分析提供了技术上的障碍。首先,小而透明的早期卵母细胞在大的不透明卵母细胞中很难识别。其次,成年斑马鱼卵巢的厚度使得获得抗体和生命染料的均匀穿透具有挑战性,这是高分辨率定量成像所必需的。第三,厚的卵巢也降低了共焦显微镜图像采集的质量。因此,斑马鱼早期的卵子发生很少被整个高级显微镜所接近,并且主要通过组织切片的分析来解决,而组织切片缺乏3D信息。由于这些限制,对早期卵子发生过程中卵母细胞发育的描述和机理理解一直缺乏。为了规避这些问题,我们和其他人已经使用幼年卵巢作为早期卵子发生的模型。与成人卵巢相比,幼年卵巢扁平且伸长。它只包含年轻的发育透明的卵母细胞。在给定的青春期卵巢中的卵母细胞一般处于每周进展的类似阶段。这为染色和共聚焦成像技术提供了极好的条件,在共聚焦成像技术中,容易发现大量所需阶段的卵母细胞。我们利用了幼年卵巢的这些特性,建立了定量显微镜和活体延时成像的方法,提供了卵子发生过程的极好视图。我们已经确定了早期卵母细胞的精确分期标准。我们还开发了短期的卵巢培养方案。
我们开发了一种分离特定卵母细胞的方法进行生化分析。这个工具箱又可以应用于卵子发生的功能丧失的遗传研究。因此,斑马鱼幼体卵巢作为研究早期脊椎动物卵子发生的模型具有很大的优势。我们描述了受精后4-10周幼年卵巢的发育过程。鱼类设施之间的环境条件不同,例如喂养方式,导致幼鱼生长速度不同。此外,在一致的条件下,在同一水箱中饲养的个体之间的生长可能有所不同。更精确的胚胎后发育的标准化测量被确定为标准长度(SL;从鼻子到尾巴底部的长度以毫米为单位,不包括尾鳍)。我们监测了实验室在4和10 WPF之间饲养的鱼类SL。在4 WPF 72%的鱼中(n=32)SL=8~11 mm,28% SL=6~8毫米。在5—6WPF, 92%的鱼(n=143)SL=10~14 mm,8%在15毫米以上。我们发现,SL=8-10mm的鱼卵巢在减数分裂开始时主要含有生殖系干细胞、卵原细胞和卵母细胞。鱼卵巢SL=10~20mm,早期双线期I期卵母细胞直径≤60μm。这些发现与以前的报告是一致的。因此,可以选择特定SL范围的卵巢来分析感兴趣的卵母细胞阶段。为了确定幼年卵巢的早期卵子发生阶段是否反映了成年卵巢的卵子发生,我们对成年卵巢的早期卵母细胞阶段进行了分析。我们解剖成人卵巢,手动去除所有大的不透明卵母细胞(III和IV期,卵母细胞形成期),并分析含有年轻卵母细胞的卵巢组织块(I和II期)。
我们证实,早期卵子发生的主要形态特征,如卵母细胞的阶段和大小、核的形状、染色体凝聚、核仁的数目和位置、Balbiani体形成和一般细胞组织(以下均描述)在幼虫和成虫卵子之间是一致的。除了有利的物理特性外,幼年卵巢还提供更强有力的统计分析。在斑马鱼中,所有鱼类的未成熟性腺最初发育为卵巢。这种性腺具有双潜能,以后或者进一步发展为卵巢,或者转变为睾丸。性别决定的过程决定了性腺的命运,要么继续发展为卵巢,要么转变为睾丸。实验室菌株的性别决定依赖于环境线索,目前尚不完全清楚,但睾丸的转变机制部分已知。在这个过程中,凋亡导致卵母细胞的丢失。当信号未知时,卵母细胞可能向体卵泡细胞发出信号以表达cyp19a1a,一种将睾酮转化为雌激素的芳香化酶,并下调抗苗管激素(amh)的表达。卵母细胞丢失导致CYP19A1A表达下调并诱导AMH的表达,AMH诱导精子发生,性腺发育为睾丸。卵母细胞凋亡的初始信号尚不清楚。在性别确定之前使用卵巢的优点是,所有个体最初都作为雌性发育,允许实验有更大的样本量。避免幼年卵巢向睾丸转变是很重要的,因为它们含有不反映正常卵子发生进程的凋亡卵母细胞。我们发现,在SL<15mm的鱼中,这种转换卵巢是罕见的(~10%,n>33),在SL=15-21mm的鱼中,这种转换卵巢的频率逐渐增加,这与先前的报道一致。因此,我们使用SL<15毫米的鱼类卵巢。转变为睾丸的卵巢在形态上是不同的,而且在解剖过程中易于识别,因为它们在形态上更类似于睾丸,更薄,更不透明,并且具有更少的清晰可见的卵母细胞。此外,在共聚焦显微镜分析中,过渡到睾丸的性腺很少有稀疏分离的卵母细胞,并且含有较松散的组织。变性的凋亡细胞核也明显且易于通过DAPI染色检测为比正常细胞核更小更亮的非晶斑点。在SL<15mm的鱼性腺出现凋亡或转变的迹象之前,性别决定过程可能开始。此外,我们对早期卵母细胞阶段的观察在幼年卵巢和成年卵巢之间是一致的,这表明它们反映了正常的卵子发生,正如其他人所报道的。因此,如果这些过程发生,它们很可能不会在转变为睾丸之前影响早期卵子发生。总之,斑马鱼幼鱼卵巢作为一个令人兴奋的遗传模型,用于研究卵巢的细胞和发育生物学、生殖细胞发育、生殖和器官发生。此外,虽然斑马鱼作为胚胎和幼体发育的模型被广泛研究,但是斑马鱼幼体后发育的研究范围要小得多。
方法:
卵母细胞分期标准;根据超微结构分析,斑马鱼卵子发生已分为四个主要阶段。第一阶段(卵母细胞直径7-140 um)跨越从减数分裂开始到减数分裂前期的细长和停滞的卵母细胞发育的早期阶段,卵母细胞在大小上显著增加。在II期(卵母细胞直径为140-340m),卵黄包膜开始形成,皮层颗粒在卵子激活后产生,在改变卵黄包膜的皮层反应中产生胞吐。III期(直径340-690m)卵母细胞被称为卵黄形成期,此时卵黄形成蛋白(蛋黄)积累。卵母细胞然后在IV期(直径690-730m)恢复并完成减数分裂I,称为卵母细胞成熟,一旦排卵就变成完全成熟的卵子(直径730-750 m)。从I到IV的所有阶段通常在成年卵巢中发现。卵子发生的第一阶段跨越减数分裂和卵母细胞分化的许多关键事件,如染色体配对和重组、卵母细胞极化和Balbiani体形成,以及单个卵母细胞从囊肿到卵泡的细胞组织变化。根据卵母细胞的卵泡生成状态,I期以前被分为IA期和IB期;在它们周围有卵泡细胞的单个卵母细胞被称为IB期,而之前的所有阶段被称为IA期。减数分裂的几个关键事件发生在IA期,这些事件先前被进一步用形态学标准表征。这些减数分裂亚期的一个更明确的标记是端粒分布动力学。在减数分裂(瘦素阶段)开始时,端粒被装载在核膜(NE)上,它们在NE上的旋转促进染色体同源性搜索。端粒然后聚集到NE的一个极点(合子期,花束形成),最终稳定配对。在花束之后,发生同源重组(粗线期),端粒在NE上径向分散,并卸载回细胞核。
我们利用端粒动力学、核形态学标准和卵母细胞大小建立了精确的分期标准,以区分卵子发生的第一阶段中的关键事件,具体地识别减数分裂的进展步骤。完整的卵母细胞的分析允许更精确的测量卵母细胞大小。由于卵母细胞在卵巢中通常不是完美的球体,因此很难测量和计算它们的绝对大小。作为卵母细胞大小的指示,我们定义了近似的卵母细胞直径。这个直径是通过使用具有最大尺寸的Z截面测量跨越卵母细胞最宽直径的两条垂直线(或接近垂直线)而产生的。这两条线的平均值是卵母细胞的大致直径。我们发现卵母细胞可以在不同的卵巢中进行一致的分期。我们对生殖系卵囊和卵巢中卵母细胞的组织及其单个卵泡的形成进行了鉴定,每个卵泡的形成都与固有的减数分裂阶段相一致。
方法:
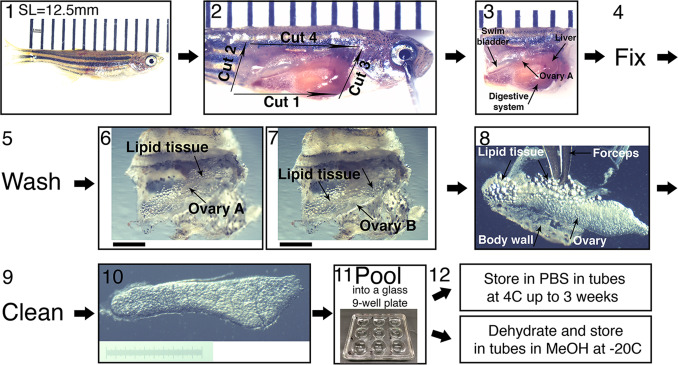
1、在冷水中对斑马鱼进行安乐死。
2、把鱼放在解剖盘上,在解剖显微镜下测量它的SL。SL=10-15mm是理想的。在这个范围较小的鱼有年轻的I期卵母细胞,而在这个范围较大的鱼有逐渐晚的I期卵母细胞。
3用一根针穿过眼睛,另一根通过尾部的底部把鱼钉在盘子上。
4、在解剖显微镜下进行如下切割:沿着腹部中线从泄殖腔解剖到鳃。从泄殖腔背部切割。从前尖到背侧切割。这些切口造成身体壁和肌肉组织的翻转。抬起这个皮瓣,沿着前后轴在其背侧边缘切开,以便完全切除。
5、切断鱼的头部和尾部并丢弃。将包括暴露的内脏器官的主干转移到冷的4%多聚甲醛(PFA)中。一个含PFA的15毫升锥形管可以放置15至20个。
6、在4°C固定过夜。
7、将碎片和PFA倒入冰面上的大塑料盘中,用移液管移除PFA,加入1xPBS。
8、在1xPBS中冲洗固定组织2次(2X)。
9、用新鲜1xPBS将主干移到玻璃培养皿中.
10、用镊子将卵巢精细解剖。
11、在解剖显微镜下摘除肝脏、消化系统和鳔。
12、找到两个卵巢,并在前端和后端切断与身体其他部位的连接点。沿着前后轴轻轻地拉出卵巢,但不直接接触卵巢,而是将脂质组织固定在卵巢周围,使其远离身体。在制备用于固定的主干片期间,一个卵巢可能粘附在被移除的体壁上并且丢失。其他卵巢仍可收集。
13、轻轻地把卵巢放在盘子底部。分离两个卵巢,在它们的后尖,其合并到输卵管中,切下。轻轻地从结缔组织和脂质细胞包围中清洁卵巢。避免在牵拉时直接接触卵巢,并通过脂质组织保持。卵巢越清洁,抗体穿透和成像越好。
14、将所有解剖卵巢放入新鲜的X1-PBS冰上的玻璃9孔板中。每个人可以根据大小选择10至16个卵巢。
15、汇集每个基因型的所有解剖卵巢有助于以后根据卵巢数量更有效地设计实验,在实验组或储存条件(PBS或MeOH)之间划分卵巢。即使在类似SL的鱼中,卵巢大小也有一定的变异性。汇集卵巢有助于在实验组之间更均匀地分布卵巢,从而获得更可重复的结果。
评论:
如前所述,在取出体壁瓣时,靠近体壁的卵巢保持附着在体壁上的时间为10~20%,因此可用体壁去除。如果从所有鱼类都需要双侧卵巢的珍贵基因型中解剖卵巢,则跳过切割2至5,进入步骤5。然后在固定后解剖两个卵巢。一旦卵巢从鱼体内被解剖出来,直到所有的脂肪细胞被去除,它们就会漂浮,并且可能会丢失。轻轻地握住卵巢,用一只钳子把它们放在盘子底部,同时用另一只钳子进行解剖。在分离两个卵巢之前移除一些脂肪细胞,以防止未处理的卵巢浮起.为了转移解剖卵巢,使用宽玻璃巴斯德吸管。烧灼吸液管的边缘,使其光滑,防止其破裂卵巢。钳子也可以轻轻使用。除使用微管稳定缓冲液(MSB)时微管染色外,然后使用37%甲醛在1XMSB中制备4%甲醛。MSB为酸性,与PFA不相容。10xPBS的pH值是7.4。
活体卵母细胞/卵巢的时间推移成像:卵母细胞的实时成像是高时间分辨率分析和更全面了解动态生物学过程的关键。许多高度动态的事件是早期卵母细胞分化和极化的基础,如卵原细胞的有丝分裂、瘦素向粗线期减数分裂卵母细胞的染色体和端粒动力学,以及粗线期到早期二线期核裂隙的形成。我们利用荧光标记的转基因和荧光活性染料建立了斑马鱼幼鱼卵巢的分离、培养和活体延时成像方案。
方法:
1、用0.02%丁卡因麻醉鱼。
2、将鱼放在解剖盘上,测量其SL。SL=10—20毫米是理想的。较小的鱼会拥有较年轻的卵母细胞,较大鱼卵母细胞发育较晚。
3、使鱼安乐死。通过尾巴底部将鱼钉在盘子上,并用镊子将前端向下夹住。去除头和尾。
4、把包括暴露的内脏器官的主干片放入一个玻璃盘中,Hank's温度升至28℃。去除消化系统。找到两个卵巢,并在前端和后端切断与身体其他部位的连接点。沿着前后轴轻轻地拉出卵巢,但不直接接触卵巢,而是将脂质组织固定在卵巢周围,使其远离身体。轻轻地把卵巢放在盘子底部。分离两个卵巢,在它们的后尖,其合并到输卵管中,切下。轻轻地从结缔组织和脂质细胞包围中清洁卵巢。避免在牵拉时直接接触卵巢,并通过脂质组织保持。卵巢越清洁,抗体穿透和成像越好。将所有剖开的卵巢放入玻璃孔板中,新鲜的HL-15加热至28℃。保持活卵巢在28°C是至关重要的。在每个卵巢的解剖过程中,保持在28°C。如果对转基因进行成像,用荧光解剖镜检查卵巢是否为阳性信号。这不能提供细胞内的分辨率,但能分辨出阴性或微弱的信号卵巢,并省去不必要的额外处理。卵巢在28°C下放置30分钟。
结论:
虽然斑马鱼尚未被充分开发用于卵子发生的研究,但它提供了几个极好的模型,包括全套卵巢的实时推移高分辨率成像,以及易于接近卵巢,在脊椎动物sp中具有强大的统计分析能力。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

