论文:池塘种植鱼腥草对罗非鱼链球菌抗病力影响及机理研究
池塘种植鱼腥草对罗非鱼链球菌抗病力影响及机理研究
季桓涛,祝璟琳,杨 弘,邹芝英,李大宇,肖 炜,李庆勇,朱德兴
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,江苏无锡214081;3.广东省惠州市渔业研究推广中心,广东惠州516002)
中草药含有多种营养物质以及一些免疫活性物质,具有促进摄食率、增重率和增长率、增强肥满度,降低鱼类死亡率等方面作用[1],可作为鱼类饲料添加剂。有研究表明饲料中添加3%和6%鱼腥草复方中草药制剂能增强尼罗罗非鱼抗病力[2-4]。链球菌病是我国罗非鱼的主要病害,近十年来给罗非鱼养殖业造成巨大损失[5-6]。当前对罗非鱼链球菌病控制以抗生素等药物为主,很难从根本上解决链球菌感染,并有药残导致的质量安全隐患。
水上栽培技术与罗非鱼养殖模式结合,可提高健康养殖效益,已成为罗非鱼养殖业重要的关注点。采用生物浮床在池塘表面种植中草药,是目前兴起的生物防控技术手段,可实现对水质的调控,调节养殖鱼类非特异性免疫反应。水上栽培也为渔民提供了增加经济效益的新渠道。目前对罗非鱼-鱼腥草共培模式缺乏数据和理论支持,需开展不同的鱼腥草配置面积对罗非鱼代谢、免疫等影响研究,优化并阐明罗非鱼-中草药共培模式。本实验通过在池塘养殖水面上种植不同面积的鱼腥草,研究了鱼腥草对罗非鱼抗病力影响,筛选出最适合的种植面积,以期为绿色防控罗非鱼链球菌病提供一种新思路。
1 材料与方法
1.1 实验材料与设计
实验鱼为吉富罗非鱼(Oreochromisniloticus),初始体质量为(150±30) g,养殖90 d后感染实验鱼,规格为(297±63) g,实验基地为广东省惠州市渔业研究推广中心。无乳链球菌编号为WC1535,由珠江水产研究所惠赠。
在面积为100 m2,深度约为1.6 m的养殖池塘(配有增氧系统)中准备面积为50 m2(5 m×10 m)帆布材质的隔离袋12个,试验组每3个设为一组,分别标记为A、B、C、D 4个组。每个帆布袋放养均重150 g的罗非鱼150尾。鱼腥草初始覆盖面积分别设置为5%(A组)、10%(B组)、15%(C组)、0(D组),即2.5、5.0、7.5、0 m2,浮床用聚氯乙烯材料(2 m×2 m)制作。养殖实验准备期,将浮床在池塘中固定,浮床间用细绳连接,将已培育出的鱼腥草苗(株高约20 cm)进行扦插,株距保持在20 cm。养殖试验开始前鱼腥草的重量约为50~130 g/m2,养殖实验结束后约在190~550 g/m2。养殖实验开始于2017年7月, 9月结束。每天投喂1次,投喂量为鱼体重的3%。养殖实验期间池塘不换水(不包含蒸发补水)。
1.2 人工感染实验
养殖90 d后,准备24个规格为500 L的养殖桶。取无乳链球菌WC1535接种于脑心浸液(BHI)中,28 ℃ 200 r/min培养24 h后,4 000 r/min离心5 min,用灭菌生理盐水洗涤后配成2.2×108cfu/mL浓度菌悬液。开展感染实验Ⅰ为不同种植面积鱼腥草感染无乳链球菌后罗非鱼死亡率影响,感染实验Ⅱ为不同种植面积鱼腥草对无乳链球菌感染后罗非鱼血清生化指标影响。感染实验期间水温28.5~30 ℃,天气晴朗。
人工感染实验I:每尾腹腔注射2.2×108cfu/mL浓度无乳链球菌悬液0.3 mL,每桶鱼10尾,每一种植面积设3个重复,连续观察72 h并记录死亡尾数。
人工感染实验II:感染方法同上,每一种植面积设3个重复,每桶鱼20尾,实验期间溶氧保持5 mg/L以上,不投喂。感染开始后每组随机取2尾濒死罗非鱼,从脑、肾分离病原菌,用梅里埃API 20 Strep试剂条进行快速鉴定。
1.3 感染鱼的采样和处理
腹腔注射感染无乳链球菌后,于0、24、48和72 h从每个养殖桶(500 L)中取鱼2尾,3个重复桶共取6尾鱼,MS-222(200 mg/L)麻醉、尾静脉取血,室温静止4 h后4 000 r/min离心10 min,取血清-20 ℃保存备用。
1.4 血液生化指标测定
在日立7600全自动生化分析仪上检测下列血清指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白/球蛋白(A/G)、葡萄糖(GLU)、胆固醇(TC)和甘油三酯(TG),试剂盒购自日本和光纯药工业株式会社产品;碱性磷酸酶(AKP)的试剂盒为购自四川迈克生物科技股份有限公司产品;超氧化物歧化酶(SOD)试剂盒为购自宁波美康生物科技有限公司产品,具体操作按试剂盒上使用说明进行。
1.5 数据分析
实验数据用Excel 2010进行整理分析,再用SPSS 19.0软件进行单因素方差(One-Way ANOVA)分析和Duncan’s多重比较检验差异性,最后用GraphPad Prism5软件绘制图,P<0.05表明差异显著。实验数用平均值±标准差(Mean±SD)表示。
2 结果
2.1 鱼腥草种植面积对罗非鱼抗链球菌病的影响
注射无乳链球菌后,4种鱼腥草种植面积池的罗非鱼都不同程度出现全身发黑、活力低下、皮肤溃烂;感染48 h后,注射鱼出现单侧突眼混浊、尾鳍损伤、肛门肿大,剖检可见肝充血肿大、脾肿大、肾肿大。感染鱼分离病原菌经API 20 Strep鉴定为无乳链球菌。
由图1可知,不同鱼腥草种植面积的感染鱼死亡率不同,以D组死亡率最高,显著高于其他组,72 h累计死亡率达到了88%;B组死亡率最低,72 h累计死亡率为58%,显著低于其他3组。
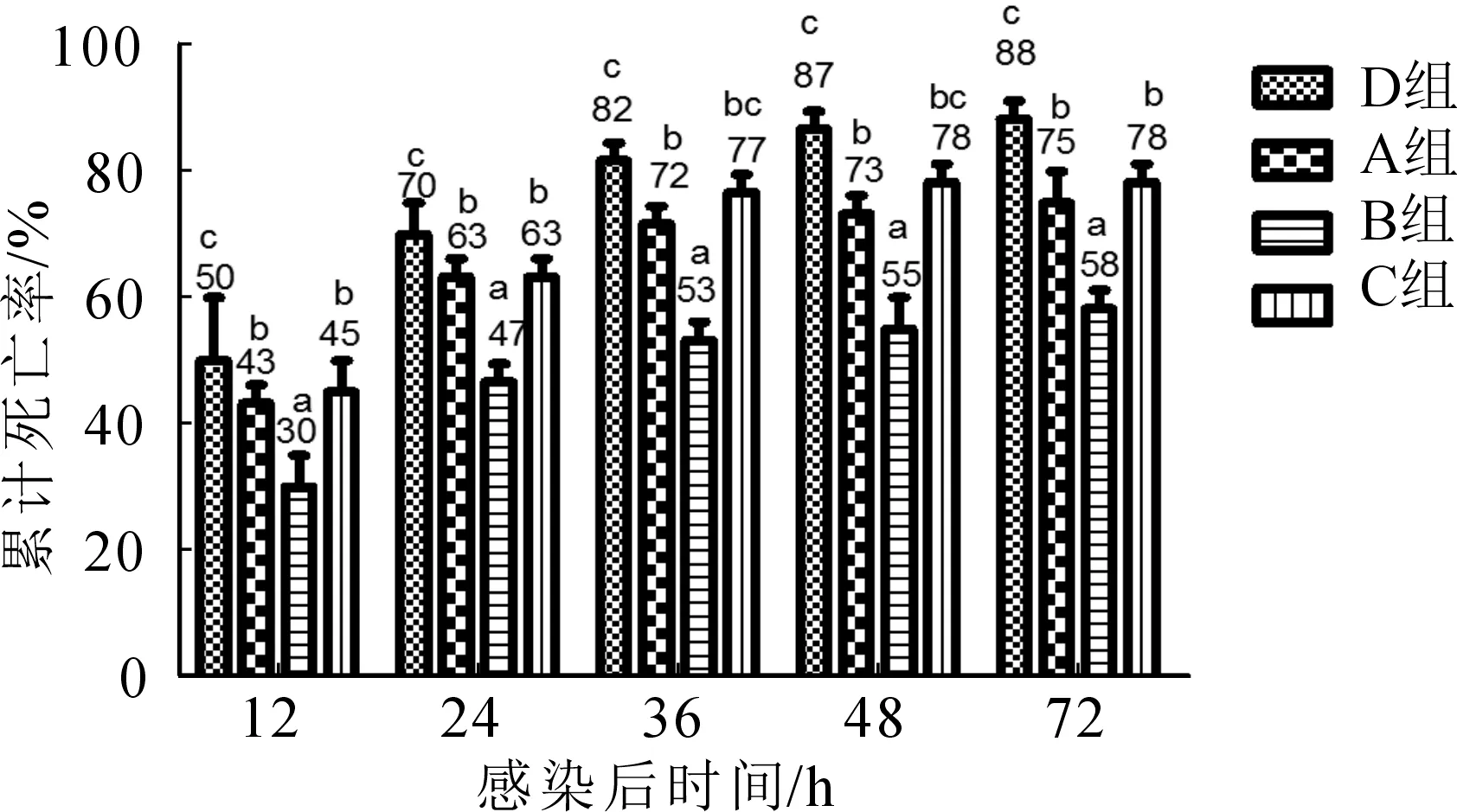
图1 四种鱼腥草种植面积下罗非鱼感染无乳链球菌后的累计死亡率Fig.1 The cumulative mortality of tilapia in four different planting proportions of Houttuynia cordata infected by S. agalactiae
2.2 鱼腥草种植面积对无乳链球菌感染罗非鱼血清ALT和AST影响
由表1可知,4组罗非鱼血清感染后血清ALT活力显著性升高,B组罗非鱼血清ALT呈现先升高后降低的趋势,在感染72 h后血清ALT活力显著性低于其他3组;4组罗非鱼感染后血清AST活力都有显著性升高,B组罗非鱼血清AST呈现先升高后降低的趋势,C组罗非鱼血清AST感染后3 d没有显著性变化。A和B组鱼腥草种植面积的罗非鱼血清AST在感染前至感染后2 d没有显著性差异, D组罗非鱼血清AST在感染72 h后显著高于其他3组。

表1 不同种植面积鱼腥草对无乳链球菌感染罗非鱼血清ALT和AST影响Tab.1 The comparison on serum glutamic-pyruvic transaminase and glutamic-oxaloacetic transamnase activities of O. niloticus infected by S. agalactiae in four different planting proportions of H. cordata
2.3 鱼腥草种植面积对无乳链球菌感染罗非鱼血清(A/G)与GLU的影响
由表2可知,A组和B组的罗非鱼血清(A/G)在感染后没有显著性差异,C组和D组的罗非鱼感染后24 h血清A/G显著性降低,感染前B组的罗非鱼血清A/G相比其他3组没有显著性差异;4种鱼腥草种植面积组的罗非鱼血清GLU在感染后显著性升高,B组的罗非鱼血清GLU在感染72 h后恢复到了感染前的水平,没有显著性差异,人工感染前的血清GLU水平B组显著性高于其他3组。

表2 不同鱼腥草种植面积对无乳链球菌感染罗非鱼血清A/G和葡萄糖的影响Tab.2 The comparison on serum A/G GLU of O. niloticus. infected by S. agalactiae in four different planting proportions of H. cordata
2.4 鱼腥草种植面积对无乳链球菌感染罗非鱼血清TC和TG的影响
由表3可知,A、C和D组的罗非鱼血清TC在感染后24 h没有显著性变化,B组的罗非鱼感染后血清TC显著性降低,4种鱼腥草种植面积组的罗非鱼在感染前血清TC没有显著性差异,A组和B组的罗非鱼血清TC在感染48 h和72 h后显著性低于其他2组;B、C和D组的罗非鱼血清TG感染前后24 h没有显著性差异,A、B和C组的罗非鱼在感染前和感染24 h后血清TG显著性低于D组。

表3 不同鱼腥草种植面积对无乳链球菌感染罗非鱼血清TC和TG的影响Tab.3 The comparison on serum cholesterol total and glycerin trilaurate of O.niloticus. infected by S. agalactiae in four different planting proportions of H. cordata
2.5 鱼腥草种植面积对无乳链球菌感染下罗非鱼血清AKP和SOD的影响
由表4可知,4种鱼腥草种植面积的罗非鱼血清AKP在感染后24 h显著性升高,而B组的罗非鱼血清AKP在感染前和感染后24 h和72 h显著性低于其他3组;4种鱼腥草种植面积组罗非鱼的血清SOD在感染后24 h显著性升高,B、C和D组的罗非鱼血清SOD在感染72 h后恢复到感染前水平,没有显著性差异,而D组的罗非鱼血清SOD显著性高于其他3组,B组的罗非鱼血清SOD在感染前和感染48、72 h显著性低于其他3组。

表4 不同鱼腥草种植面积下罗非鱼感染无乳链球菌后血清AKP和SOD的变化Tab.4 The comparison on serum alkaline phosphatase and SOD activities of O.niloticus. infected by S. agalactiae in four different planting proportions of H. cordata
3 讨论
3.1 不同鱼腥草种植面积对罗非鱼抗链球菌病能力的差异分析
本研究改变以往的养殖模式,在水体上种植不同面积的鱼腥草,有良好的成效。实验结果表明,D组的罗非鱼感染链球菌后死亡率最高,B组的罗非鱼死亡率最低,一方面是因为种植鱼腥草改善了养殖水体水质,有效地促进了水体自净功能,这与史丽娜等[7]和郑尧等[8]的研究结果相符;另一方面罗非鱼啃食鱼腥草根部,根部释放生物碱等物质促进机体免疫应答的能力,提高了抗应激能力,进而提高了罗非鱼存活率,郑尧等[9-10]的研究结果也表明罗非鱼养殖池塘面积水面种植鱼腥草能显著增强养殖罗非鱼IgM、TRF、TNF-α、EGF等免疫功能分子水平,降低罗非鱼链球菌等病害发生。C组的罗非鱼感染链球菌后死亡率高于B组,分析原因是高密度种植的鱼腥草通过呼吸作用消耗大量养分和分泌过多的生物碱等物质而影响罗非鱼的存活率,而钟全福[11]研究也证实并不是无限制提高浮床植物覆盖率都对池塘有利。
3.2 不同鱼腥草种植面积对无乳链球菌感染罗非鱼后血清生化指标的变化
血液生化指标是反映鱼类生理代谢状态变化和鱼体对病原菌的生理反应,评价鱼体健康状况的重要指标[12]。有研究显示异育银鲫(Carassiusauratusgibelio)在感染鲤疱疹病毒Ⅱ型(CyHV-2)后血清ALT与AST明显升高[13]。国内也曾报道欧洲鳗鲡(Anguillaanguilla)患“狂游病”,大黄鱼(Pseudosciaenacrocea)被哈维氏弧菌(Vibrioharveyi)感染后,转氨酶含量都会显著升高,其原因是肝脏组织受到损伤[14]。本实验中,4种鱼腥草种植面积组的罗非鱼,感染无乳链球菌后,细胞中大量转氨酶逸入血液,血清ALT和AST都出现显著性升高,说明肝脏在感染后受到了损伤,没有种植鱼腥草组ALT在感染后显著性高于其他种植鱼腥草的组,而C组的罗非鱼血清ALT和AST在感染前最大,C组的罗非鱼血清AST在感染后期也显著性高于其他3组,说明C组的罗非鱼可能在感染前肝脏已经产生了胁迫损伤,B组的罗非鱼血清ALT和AST呈现先升高后降低的趋势,感染后72 h恢复到感染前水平,分析原因可能是种植鱼腥草去除了水体的氮、磷,减轻了氨氮对罗非鱼的胁迫,从而增加了组织细胞对外界刺激的耐受性,另外鱼腥草释放免疫活性物质刺激机体产生免疫代谢,降低肝脏受损程度。
血液中的GLU是生命体进行生化代谢活动所需能量的来源之一,也是维持生命稳定的重要能源之一,在机体的正常生理代谢活动下,机体内含量相对稳定,但会随着机体活动和环境因子的改变而变化。因此血液中GLU的含量可作为鱼体响应环境应激因子的指示指标[15]。本实验中4种鱼腥草种植面积组的罗非鱼血清GLU在感染后都有显著性的升高,说明罗非鱼机体为抵抗病原菌的入侵增加了对葡萄糖的需求,以应对免疫反应消耗的能量,因此血液葡萄糖含量呈现上升趋势。Chen等[16]研究也发现,使用创伤弧菌(Vibriovulnificus)和海豚链球菌(Streptococcusiniae)感染尼罗罗非鱼后,血清中葡萄糖水平显著高于对照组。10%鱼腥草种植面积的罗非鱼血清GLU在感染72 h后恢复到感染前的水平,说明鱼腥草在感染后期对鱼体抵御病原菌起到一定辅助作用。但是也有一些鱼类感染病原菌葡萄糖呈现下降趋势[17],可能是病原菌感染后鱼类开始食欲减退不进食,导致血清GLU水平降低。人工感染前的血清GLU水平,B组显著性高于其他3组,感染3 d后恢复到感染前水平,分析原因为罗非鱼食用鱼腥草根部提高了感染前血清中的GLU水平。实验结果表明,B组对血糖水平有更好的调控作用[18]。
血清蛋白能够起到维持体内内环境的稳定,调节酸碱平衡和引导物质的运输,并且维持血浆正常的机体渗透压的作用。因此ALO和GLO含量的变化可以作为鱼类应对外界刺激做出反应的参考指标[19],A/G比值可以作为衡量机体正常的蛋白质维持程度的重要指标[20]。祝璟琳等[21]研究表明埃及尼罗罗非鱼在高温应激下感染无乳链球菌后A/G的比值有下降趋势。本实验中D组的罗非鱼血清A/G在感染后显著性降低,强俊等[20]研究也表明埃及尼罗与红罗非鱼随链球菌感染时间的延长,A/G比值基本呈下降的趋势。罗辉等[22]研究表明齐口裂腹鱼感染嗜水气单胞菌后72 h内血清A/G的比值先升高后降低。本研究中面积为“0”组的罗非鱼血清的A/G呈现先升高后降低的趋势,说明鱼腥草种植超过一定面积,某些活性物质的过量累积可能对罗非鱼免疫应激能力产生副作用,而A组和B组的罗非鱼血清A/G在感染前后没有显著性差异,说明可能鱼腥草中的生物碱等物质对蛋白的维持度较好[18],提高了罗非鱼对病原菌的应激。
AKP属于溶酶体酶的一部分,在机体抵御外界不良应激发挥着重要作用[23],本实验中罗非鱼血清AKP都是呈现先升高后降低的趋势,10%鱼腥草种植面积的罗非鱼血清AKP在感染前和感染后24、72 h都要显著性低于其他3组,罗非鱼在感染后机体的代谢活动加剧用来抵御病原菌的侵袭。说明无乳链球菌感染前后对B组的代谢影响最小。 SOD能够及时清除体内的氧自由基,促进机体免疫调节的能力,能够清除对机体有危害作用的物质,防御过氧化损害,提高免疫力[24]。本实验中4种种植面积的血清SOD在感染后都有显著性升高,鱼体受到病原菌侵袭后激活了SOD的诱导酶,导致上升。B组的罗非鱼血清SOD在感染前和感染48、72 h都显著性低于其他3组,说明可能种植鱼腥草让罗非鱼提高了对外界刺激的耐受力,阻碍诱导酶激活,介导各种免疫反应。实验结果表明,B组的罗非鱼在抗病能力上优于其他3组。
TG和TC水平的变化也可以作为鱼类对外界刺激或病毒感染的反应。血清TG和TC主要来源于肠道吸收脂质和肝脏脂肪代谢[25]。徐晓津等[26]研究发现,当大黄鱼感染哈维氏弧菌(Vibrioharveyi)后,血清中TG和TC的水平显著性低于对照组。这与本试验结论相似,本实验中A、C和D组的罗非鱼血清TC在感染后24 h没有显著性变化,在感染后期出现下降趋势,B组的罗非鱼感染后血清TC显著性降低,这说明可能在感染后增加了对TC的利用以抵抗病原菌,满足自身需要的能量,在感染后期随着肝脏的损伤,也可能引起血清中TC的下降。A组的罗非鱼血清TG感染后呈现持续降低的趋势,A、B和C组的罗非鱼在感染前和感染后24、48 h血清TG显著性低于D组,这和陈寅儿等[27]的研究中鲈(Lateolabraxjaponicus)感染病原菌后血清中甘油三酯明显低于对照组的结果相似,证实B组的罗非鱼更能有效地调节血清TC和TG,以应对外界刺激。
4 结论
B组死亡率最低,血清生化指标优于对照组和其他鱼腥草种植面积组。罗非鱼-鱼腥草共培养殖模式鱼腥草的最佳覆盖比例为10%。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

