论文:鲤疱疹病毒3型T分离株主要免疫原性蛋白的鉴定

鲤疱疹病毒3型T分离株主要免疫原性蛋白的鉴定
郑树城,王 庆,李莹莹,王英英,曾伟伟,任 燕,石存斌
(1.中国水产科学研究院珠江水产研究所,农业部渔药创制重点实验室,广东省水产动物免疫技术重点实验室,广州 510380;2.上海海洋大学水产与生命学院,上海 201306)
鲤疱疹病毒3型,又称为锦鲤疱疹病毒(Koi herpesvirus,KHV),是引起鲤(CyprinuscarpioLinnaeus )、锦鲤及其变种锦鲤疱疹病毒病(Koi herpesvirus disease,KHVD)的病原,死亡率高达80%以上,对全世界多个国家地区的鲤鱼及锦鲤养殖产业造成了巨大的经济损失[1]。CyHV-3隶属于疱疹病毒目异疱疹病毒科鲤疱疹病毒属,是具有囊膜的双链DNA病毒[2],病毒颗粒直径为167~200 nm,基因组全长295 kbp,共编码164个开放阅读框(Open reading frame,ORF),是已知基因组最大的疱疹病毒[3-5]。生物质谱技术鉴定结果表明,CyHV-3含有46个结构蛋白,包括16个囊膜蛋白、3个衣壳蛋白、2个皮层蛋白和25个未知蛋白[6-7]。
虽然质谱鉴定发现CyHV-3可能含有46个蛋白,但对于CyHV-3的免疫原性蛋白的研究却非常有限。其中,ORF81编码的囊膜蛋白是研究较早也是被多数学者广泛认可的主要免疫原性蛋白之一[8],以ORF81为靶基因设计的DNA疫苗在试验中显示具有较高的免疫保护率[9]。Fuchs等[10]对部分潜在的CyHV-3结构蛋白进行了研究,结果显示囊膜蛋白ORF25、ORF65、ORF148和ORF149具有良好的免疫原性,Zhou等[11]设计的ORF25 DNA疫苗在鱼体试验上也证明了其具有良好的免疫保护效果。最近,Monaghan等[12]利用CyHV-3核衣壳制备的单克隆抗体和质谱基质辅助激光解析离子化-飞行时间质谱(Matrix assisted laser desorption ionization-time of flight,MALDI-TOF/TOF)鉴定到一个具有良好免疫原性的新蛋白ORF84。另外,有研究表明非结构蛋白ORF12可能也具有免疫原性[13]。
本试验采用20%~66%蔗糖密度梯度超速离心方法对CyHV-3病毒悬液进行纯化,经SDS-PAGE和考马斯亮蓝染色后进行Western blotting分析,结合质谱技术筛选免疫原性蛋白,为CyHV-3血清学诊断方法的建立、亚单位疫苗或DNA疫苗的研制提供更多候选抗原。
1 材料与方法
1.1 材料
鲤鱼CCB细胞系[14]和鲤疱疹病毒3型T分离株由德国动物健康研究院(FLI)病原学研究所Sven.M Bergmann教授赠送;抗CyHV-3血清采自感染CyHV-3的病鱼;鼠源抗锦鲤IgM单克隆抗体由本实验室制备。
蔗糖Sucrose购自Sigma公司;SDS-PAGE预制胶、蛋白Marker、凝胶电泳缓冲液和转膜缓冲液购自Thermo Scientific公司;HRP标记的山羊抗鼠IgG购自武汉博士德生物工程有限公司;增强型HRP-DAB底物显色试剂盒(PA110)购自天根生化科技有限公司。
1.2 方法
1.2.1 病毒增殖与纯化
细胞培养、病毒感染和增殖参考文献[15]描述的方法。将出现明显细胞病变的细胞进行冻融处理,于10 ℃下5 000 r/min离心30 min,收集上清液于10 ℃下32 000 r/min离心1.5 h,弃上清,用TNE缓冲液重悬沉淀;将病毒悬液加入由质量体积比分别为20%、40%、50%和66%的蔗糖密度梯度离心管上层,于10 ℃下25 000 r/min离心1 h;收集每一层的病毒样品,加入TN缓冲液后于10 ℃下25 000 r/min离心30 min,收集沉淀,用TN缓冲液重悬,将纯化的病毒颗粒吸附于碳膜镍网上,3%的磷钨酸(pH7.2~7.4)负染1 min后在透射电子显微镜下观察。
1.2.2 SDS-PAGE和考马斯亮蓝染色
聚丙烯酰胺凝胶由12%的分离胶和4%的浓缩胶组成,将纯化的病毒与5×蛋白上样缓冲液按比例混合后在沸水中水浴10 min,冷却后点样进行电泳。电泳结束后,其中一块凝胶用考马斯亮蓝染色和脱色,并用凝胶成像系统扫描。
1.2.3 Western blotting
将上述SDS-PAGE分离后的另一块凝胶用湿转的方法转移至硝酸纤维素(NC)膜,5%的脱脂奶粉室温封闭3 h,然后用含有0.05%吐温的PBS (PBST )清洗3次,每次10 min;用1∶200稀释的锦鲤抗CyHV-3的阳性血清4 ℃下孵育过夜,然后用0.05%的PBST清洗3次,每次10 min;加入1∶1 000稀释的鼠抗锦鲤IgM单抗室温孵育1.5 h,接着用0.05%的PBST清洗3次,每次10 min;最后加入1∶5 000稀释的HRP标记羊抗鼠IgG室温孵育1 h,用0.05%的PBST清洗3次后进行DAB显色。
1.2.4 质谱分析
仔细比对考马斯亮蓝脱色凝胶和DAB显色的NC膜,将与NC膜显色明显条带相应位置的考马斯亮蓝脱色凝胶切出,进行胶内酶解,运用液相色谱串联质谱(Liquid chromatography tandem mass spectrometry,LC-MS/MS)进行分析,质谱原始数据用MASCOT在uniprot数据库中检索。
2 结果
2.1 病毒纯化
病毒纯化后在电镜下观察到许多典型的呈圆形状完整囊膜包裹或只有裸露核衣壳的CyHV-3病毒颗粒,颗粒直径为150~200 nm(图1),与之前的报道一致。

图1 透射电镜下纯化的CyHV-3颗粒Fig.1 Purified particles of CyHV-3 under transmission electron microscope(a)黑色细箭头为完整的CyHV-3病毒颗粒,黑色粗箭头为囊膜破损的CyHV-3病毒颗粒,白色细箭头为裸露的核衣壳;(b)图(a)中方框放大部分,图中标尺为200 nm.
2.2 SDS-PAGE和Western blotting结果
将纯化的病毒进行SDS-PAGE分析,考马斯亮蓝染色和脱色后可见到许多丰度不一的蛋白条带[图2(a)]。以抗CyHV-3锦鲤阳性血清作为一抗进行Western blotting,结果显示多条蛋白可以被阳性血清识别,具有特异性免疫反应[图2(b)]。
2.3 质谱分析
剪切其中4条具有明显特异性免疫反应的蛋白胶条进行LC-MS/MS分析,4个蛋白鉴定结果分别为ORF92、ORF66、ORF72和ORF81[图2(b)和表1]。
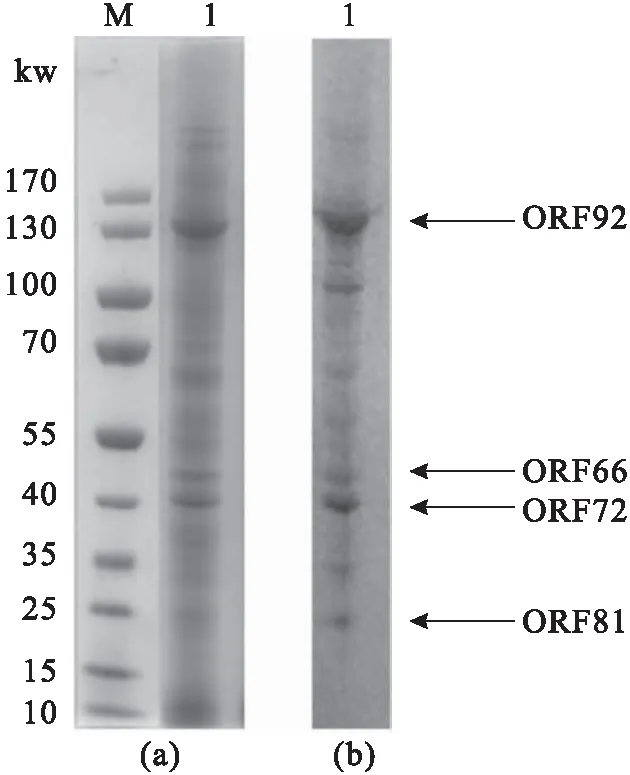
图2 纯化的CyHV-3病毒SDS-PAGE电泳结果(a)和Western blotting结果(b)Fig.2 Results of SDS-PAGE of purified CyHV-3 virions (a) and Western blotting analysis (b)1:纯化的CyHV-3病毒颗粒,M:蛋白标准.
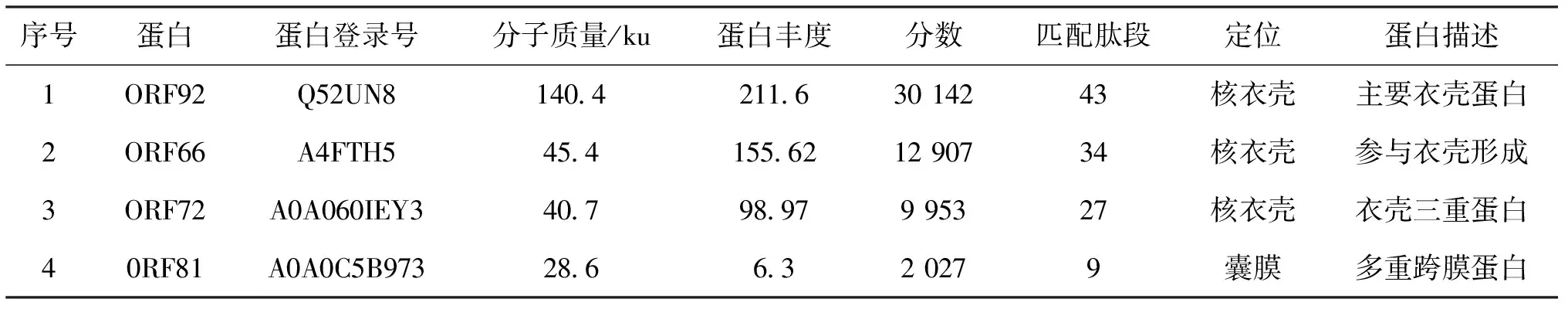
表1 CyHV-3主要免疫原性蛋白LC-MS/MS鉴定Tab.1 Identification of major immunogenic proteins from CyHV-3 by LC-MS/MS
3 讨论
锦鲤疱疹病毒病自从上世纪90年代在欧洲暴发以来,已传播至世界多个国家地区[16-17],最近的文献报道显示,该病已波及越南和伊朗等国家[18-19]。我国是2002年在深圳进口的锦鲤中首次检测到[20],之后在广州、海南和东北等地区均有KHVD暴发的报道[21-22]。遗憾的是,目前仍没有针对KHVD的有效疫苗,虽然之前的研究表明CyHV-3减毒疫苗和改良的活疫苗在鱼体试验中显示具有显著的保护作用[23-25],但减毒疫苗存在毒力返强和潜伏感染的风险,安全隐患不可忽视。
相较传统的疫苗,基因工程疫苗如DNA疫苗和亚单位疫苗,因具有易制备、稳定和高效等优点,已成为许多水生动物疾病疫苗的重要研究方向。其中,部分DNA疫苗和亚单位疫苗由于具有良好的免疫保护效果,已正式投入市场使用,进入渔用疫苗商业化,如加拿大分别于2002年和2005年批准生产的传染性胰腺坏死病毒亚单位疫苗和传染性造血器官坏死病毒DNA疫苗[26]。因此,在研制传统的减毒疫苗或灭活疫苗的同时,基因工程疫苗的研制无疑为水生动物疾病的防控策略提供了更多选择。而选择具有良好免疫原性的蛋白是研制这类疫苗的重要基础,因此,本研究基于蛋白质组学和免疫学的方法鉴定了几个CyHV-3免疫原性蛋白,为KHVD基因工程疫苗的研制提供了重要的候选抗原。
基于蛋白质组学和免疫学的交叉学科称为免疫蛋白质组学(Immunoproteomics),它结合了蛋白质组学高通量的优势和免疫学的技术方法,在病毒和细菌等病原微生物的免疫原性蛋白研究中广泛应用,有力地推动了该研究领域的发展。Jang等[27]分别将自然感染淋巴囊肿病毒(Lymphocystis disease virus,LCDV)和LCDV灭活疫苗免疫的褐牙鲆(Paralichthysolivaceus)抗血清通过一维凝胶电泳、免疫印迹分析和质谱分析的方法对褐牙鲆抗原性蛋白进行筛选,结果显示LCDV灭活疫苗免疫后的褐牙鲆能产生识别LCDV主要衣壳蛋白的抗体,表明LCDV主要衣壳蛋白具有良好的免疫原性,可作为疫苗制备的候选抗原。Shin等[28]也通过同样的技术方法对感染褐牙鲆的海豚链球菌(Streptococcusiniae)免疫原性蛋白进行了筛选。免疫蛋白质组学的应用为病原微生物免疫原性蛋白的筛选提供了便利的工具,也为相关疾病疫苗的研制奠定了基础。
本次质谱鉴定的4个蛋白中,有3个是衣壳蛋白(ORF66、ORF72和ORF92),其中ORF66和ORF72为首次鉴定的具有免疫原性的衣壳蛋白。之前的研究发现CyHV-3免疫原性蛋白多数为囊膜蛋白[8,10,11],但本研究的结果表明衣壳蛋白可能是激发宿主产生抗体的主要抗原,囊膜病毒入侵宿主后需要通过病毒囊膜与宿主细胞膜发生膜融合进入细胞质,因此病毒核衣壳可能在进入细胞质的过程中激发了宿主产生体液免疫应答,但具体的分子作用机制有待进一步研究。另外,也有文献报道用本文类似的方法只鉴定到一个免疫原性蛋白ORF12,该蛋白为肿瘤坏死因子受体的同源蛋白[13]。但ORF12是否真正具有免疫原性,作者并未对其进行后续鉴定。本研究只对其中几条明显特异性免疫反应的蛋白条带进行了质谱分析,未对所有特异性免疫反应的蛋白进行进一步鉴定。因此,关于CyHV-3的免疫原性蛋白仍需要更多方法来确定。
本研究采用锦鲤抗CyHV-3阳性血清作为一抗对纯化CyHV-3病毒颗粒进行免疫印迹分析,对其中4条具有明显特异性免疫反应的蛋白胶条进行LC-MS/MS鉴定,结果表明ORF92、ORF66、ORF72和ORF81为免疫原性蛋白,可作为血清学诊断方法的建立和亚单位疫苗、DNA疫苗研制的候选抗原。
[1]Hedrick R P,Gilad O,Yun S,et al.A herpesvirus associated with mass mortality of juvenile and adult koi,a strain of common carp[J].J Aquat Anim Health,2000,12(1):44-57.
[2]Davison A J,Eberle R,Ehlers B,et al.The order herpesvirales[J].Arch Virol,2009,154(1):171-177.
[3]Aoki T,Hirono I,Kurokawa K,et al.Genome sequences of three Koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J].J Virol,2007,81(10):5058-5065.
[4]Zhang Q Y,Gui J F.Virus genomes and virus-host interactions in aquaculture animals[J].Sci China Life Sci,2015,58(2):156.
[5]Zeng X T,Chen Z Y,Deng Y S,et al.Complete genome sequence and architecture of crucian carp Carassius auratus herpesvirus (CaHV)[J].Arch Virol,2016,161(12):3577-3581.
[6]Yi Y,Zhang H,Lee X,et al.Extracellular virion proteins of two Chinese CyHV-3/KHV isolates,and identification of two novel envelope proteins[J].Virus Res,2014,191:108-116.
[7]Michel B,Leroy B,Raj V S,et al.The genome of Cyprinid herpesvirus 3 encodes 40 proteins incorporated in mature virions[J].J Gen Virol,2010,91:452-462.
[8]Rosenkranz D,Klupp B G,Teifke J P,et al.Identification of envelope protein porf81 of Koi herpesvirus[J].J Gen Virol,2008,89:896-900.
[9]Zhou J X,Xue J,Wang Q,et al.Vaccination of plasmid DNA encodingorf81 gene of cj strains of KHV provides protection to immunized carp[J].In Vitro Cell Dev Biol-Anim,2014,50(6):489-495.
[10]Fuchs W,Granzow H,Dauber M,et al.Identification of structural proteins of Koi herpesvirus[J].Arch Virol,2014,159(12):3257-3268.
[11]Zhou J X,Wang H,Li X W,et al.Construction of KHV-cjORF25 DNA vaccine and immune challenge test[J].J Fish Dis,2014,37(4):319-325.
[12]Monaghan S J,Thompson K D,Bron J E,et al.Expression of immunogenic structural proteins of Cyprinid herpesvirus 3 in vitro assessed using immunofluorescence[J].Vet Res,2016,47.
[13]Kattlun J,Menanteau-Ledouble S,El-Matbouli M.Non-structural protein porf 12 of Cyprinid herpesvirus 3 is recognized by the immune system of the common carpCyprinuscarpio[J].Dis Aqua Org,2014,111(3):269-273.
[14]Neukirch M,Bíttcher K,Bunnajirakul S.Isolation of a virus from koi with altered gills[J].Bull Eur Assoc Fish Pathol,1999,19(5):221-224.
[15]Wang Y Y,Zeng W W,Li Y Y,et al.Development and characterization of a cell line from the snout of koi (Cyprinuscarpio,L.) for detection of Koi herpesvirus[J].Aquaculture,2015,435(83):310-317.
[16]Bretzinger A,Fischer-Scherl T,Oumouna M,et al.Mass mortalities in koi carp,Cyprinuscarpio,associated with gill and skin disease[J].Bull Eur Assoc Fish Pathol,1999,19(5):182-185.
[17]Boutier M,Ronsmans M,Rakus K,et al.Cyprinid herpesvirus 3:An archetype of fish alloherpesviruses[J].Adv Virus Res,2015,93:161-256.
[18]Rahmati-Holasoo H,Zargar A,Ahmadivand S,et al.First detection of Koi herpesvirus from koi,CyprinuscarpioL.Experiencing mass mortalities in iran:Clinical,histopathological and molecular study[J].J Fish Dis,2016,39(10):1153-1163.
[19]Mayrhofer R,Pucher J,Saleh M,et al.First detection of Cyprinid herpesvirus 3 in cultured common carp in vietnam[J].Fish Pathol,2016,51(1):28-31.
[20]刘 荭,史秀杰,高隆英,等.进口锦鲤暴发病病原的nested-PCR鉴定[J].华中农业大学学报,2002,21(5):414-418.
[21]李莹莹,王 庆,曾伟伟,等.锦鲤疱疹病毒GZ1301株的分离与鉴定[J].水产学报,2014,38(8):1159-1166.
[22]朱 霞,李新伟,王 好,等.一株锦鲤疱疹病毒的分离与鉴定[J].中国预防兽医学报,2011,33(5):340-343.
[23]Ronen A,Perelberg A,Abramowitz J,et al.Efficient vaccine against the virus causing a lethal disease in culturedCyprinuscarpio[J].Vaccine,2003,21(32):4677-4684.
[24]Perelberg A,Ronen A,Hutoran M,et al.Protection of culturedCyprinuscarpioagainst a lethal viral disease by an attenuated virus vaccine[J].Vaccine,2005,23(26):3396-3403.
[25]Weber E P S,Malm K V,Yun S C,et al.Efficacy and safety of a modified-live Cyprinid herpesvirus 3 vaccine in koi (Cyprinuscarpiokoi) for prevention of koi herpesvirus disease[J].Am J Vet Res,2014,75(10):899-904.
[26]吴淑勤,陶家发,巩 华,等.渔用疫苗发展现状及趋势[J].中国渔业质量与标准,2014,4(1):1-13.
[27]Jang H B,Kim Y R,Cha I S,et al.Detection of antigenic proteins expressed by lymphocystis virus as vaccine candidates in olive flounder,Paralichthysolivaceus(Temminck & Schlegel)[J].J Fish Dis,2011,34(7):555-562.
[28]Shin G W,Palaksha K J,Kim Y R,et al.Application of immunoproteomics in developing aStreptococcusiniaevaccine for olive flounder (Paralichthysolivaceus)[J].J Chromatogr B Analyt Technol Biomed Life Sci,2006,849(1-2):315-322.
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊",将会定期向你推送信息!

