牛蛙歪头白内障病的病原鉴定和药敏试验

牛蛙歪头白内障病的病原鉴定和药敏试验
赵婧,林旭埜,*,陈汉锶,邹伟斌
[1.仲恺农业工程学院动物科技学院,广东 广州 510630;2.海泰达生物科技(广州)有限公司,广东 广州 510630]
牛蛙(Rana catesbeiana)属于脊索动物门,两栖纲,蛙科,蛙属,原产北美,是世界上最著名的大型食用蛙类[1]。牛蛙具有易养、适应性强、繁殖快、生长速度快、食性杂、饵料易解决等特点,养殖利润相当可观[2]。随着养殖规模的扩大和放养密度的提高,各种病害相继发生,并成为牛蛙养殖业发展的一个重大障碍[3]。蛙类病害主要分为细菌性疾病、真菌性疾病、寄生虫性疾病[4]。细菌性疾病主要有由脑膜炎败血伊丽莎白菌引起的蛙脑膜炎败血金黄杆菌病;由嗜水产气单胞菌引起的蛙红腿病;由链球菌引起的链球菌病;由肠型点状气单胞菌引起的蛙肠胃炎病等。真菌性疾病主要有由多种水霉引起的水霉病等;寄生虫性疾病主要有蛙车轮虫病、纤毛虫病等。
肺炎克雷伯菌(Klebsiella pneumoniae)为革兰阴性菌,属于肠杆菌科(Enterobacteriaceae)克雷伯菌属(klebsiella),分3 个亚种:肺炎亚种(subsp.pneumoniae)、鼻炎亚种(subsp.azaenae)和鼻硬结亚种(subsp.rhinoscleromatis)。由Friediander 于1893年从患大叶性肺炎病人的肺组织中首次分离到[5]。兼性厌氧,氧化酶为阴性[6],能够引起动物肺炎、肠炎、脑膜炎和败血症等严重疾病,也是一种重要的人兽共患病原菌[7]。
米尔伊丽莎白菌(Elizabethkingia miricola, EMI)为属于黄杆菌纲(Flavobacteria)黄杆菌目(Flavobacteriales)黄杆菌科(Flavobacteriaceae)伊丽莎白菌属(Elizabethkingia)细菌,该属下还有脑膜炎败血伊丽莎白菌(Elizabethkingia meningoseptica, EME)、按蚊伊丽莎白菌(Elizabethkingia anophelis, EAN)和植物内生伊丽莎白菌(Elizabethkingia endophytica, EEN)。米尔伊丽莎白菌(EMI)于2003 年在和平空间站冷凝水中被首次发现,为革兰阴性非发酵细菌[8]。
近期,江门市某牛蛙养殖场流行一种疾病,患病蛙出现头向一侧歪斜、运动迟缓、在水中旋转、眼睛表面出现白色薄膜、食欲废绝等症状,甚至死亡。为探明牛蛙病因,现通过分离鉴定患病牛蛙的病原,观察致病菌感染牛蛙后的组织病理学变化,并对分离菌株的耐药性和致病性进行试验,以期为临床治疗提供依据。
1 材料与方法
1.1 时间与地点
2023 年4—5 月,试验地位于广州市天河区暨南大学科技产业大厦四楼。
1.2 材料
从广东省江门市某牛蛙养殖场,取有歪头白眼等症状的病蛙,带回实验室后立即解剖,对病原菌进行分离培养。再选择80 只健康牛蛙,开展动物感染试验。
1.3 试剂和仪器
血琼脂平板(自广州环凯微生物有限公司)、生化编码鉴定盒(环凯微生物有限公司)、抗生素药敏片(杭州微生物试剂有限公司)。
2 试验方法
2.1 病原菌的分离、纯化培养
在生物安全柜中进行细菌分离。随机选取具有典型症状的病蛙,解剖前用75%乙醇消毒全身。将剪刀加热消毒处理后,用剪刀背面烙烤严重病变组织表面,再用剪刀剪开组织,将无菌接种环伸入切口,轻轻转动,蘸取病蛙的脑和内脏组织,划线于血琼脂平板上,培养箱中37 ℃培养24~48 h,观察分离细菌的菌落形态。挑取优势菌落,进一步纯化培养,用于形态学观察、生理生化分析、分子鉴定和动物回归试验。
2.2 形态学观察
将分离得到的各菌株,分别进行革兰染色,并在显微镜下观察、记录下菌落的形态特点。
2.3 病原菌的鉴定
2.3.1 基因分子鉴定
分别提取分离得到的优势菌基因组的DNA,对菌株进行16S rRNA 基因PCR 扩增。16S rRNA 基因上游引物为:5’-AGAGTTTTGATCCTGGCTCAG-3’;下游引物为:5’-AAGGAGGTGATCCAGCCGCA-3’。反应条件:95 ℃1 min;98 ℃15 s;55 ℃30 s;72 ℃2 min;35 个循环;72 ℃10 min。扩增产物经1%琼脂糖凝胶电泳验证为目的片段大小后,送至生工生物工程(上海)股份有限公司纯化和测序。测序得到的基因序列在NCBI 中进行BLAST 分析比对,从数据库获得相关属种的16S rRNA 基因序列,找到相似性较高的菌株,用MEGA11.0 软件构建系统发育进化树。
2.3.2 生理生化鉴定
分离得到的菌株生理生化指标,采用生化编码鉴定盒进行检测。检测项目为山梨醇、纤维二糖、棉籽糖、蛋白胨水、西蒙氏柠檬酸盐、鸟氨酸脱羧酶、赖氨酸脱羧酶、半固体琼脂、葡萄糖、硫化氢、乳糖、尿素、七叶苷、甘露糖、阿拉伯糖、氰化钾生长试验管,观察试验结果。生化编码鉴定盒均购自环凯微生物有限公司,操作方法详见该试剂盒说明书,参照常见细菌系统鉴定手册[9]中细菌生理生化指标进行确认。
2.4 药敏试验
采用纸片琼脂扩散法,检测菌株药物敏感性。首先将分离得到的菌株,分别接种于LB 液体培养基,28 ℃振荡培养24 h 后,于8 000 r/min 离心10 min 沉淀菌体,用无菌PBS 稀释菌体至0.5 mcf,取20 μL 菌悬液均匀涂布于LB 固体平板上,待菌液被吸收后,向培养基贴不同抗生素药敏纸片,置于28 ℃恒温培养箱中倒置培养24 h,测量抑菌圈直径,并根据杭州微生物试剂有限公司药敏试剂判断标准来判定结果。
2.5 动物感染试验
选择80 只健康牛蛙,试验前在养殖箱里暂养2 周,每天换1 次水,水温保持在25~28 ℃,正常投喂商品饲料,设置4 框,每框20 只。将纯化后分离得到的菌株,分别接种到LB 液体培养基中培养12 h,离心收集菌体,用无菌生理盐水将菌株配置成1×106cfu/mL 的菌悬液。
将牛蛙随机分为3 个感染组和1 个阴性对照组,每组20 只。将分离得到的菌株的菌悬液和分离得到的菌株的混合菌悬液,分别注射到3 个感染组的健康牛蛙腹腔,剂量为0.2 mL/只,每组注射20 只,阴性对照组则腹腔注射无菌PBS缓冲液(0.2 mL/只)。每日观察,记录牛蛙发病和死亡情况,连续观察20 d。
3 结果与分析
3.1 病原菌的分离、纯化培养及形态学观察
将感染的病蛙样品,接种于血琼脂培养基上培养24 h 后,从病蛙体内不同组织处取样,均分离到2种形态的优势菌落,见图1(a)(b)。
图1 病料接种在培养基培养24 h 后的形态学观察结果
由图1 可见,一种菌落呈淡黄色,圆形至椭圆形不等,略隆起,表面光滑,另一种菌落呈灰白色,多突起、质地黏稠,挑起时更易呈拉丝状。将分离菌进行革兰染色后,于普通光学显微镜油镜下观察,结果见图2(a)(b)。

图2 分离细菌革兰染色镜检结果
由图2 可见,菌体均呈红色,可初步判断分离细菌均为革兰阴性菌;一种分离菌呈短杆状比较分散的排列,另一种分离菌呈两端较钝的短粗球杆状较连续的排列。将分离菌均接种于常见的细菌分离培养基中连续培养7 d,未见其他微生物生长。将纯化后的细菌命名为JM2023A 株和JM2023B 株。
3.2 病原菌鉴定
3.2.1 基因序列分析与系统发育树的构建
用细菌通用引物扩增JM2023A 株和JM2023B株的16S rRNA 基因,扩增后进行琼脂糖凝胶电泳。结果显示,扩增出1 600 bp 左右的目的条带(图3),将PCR 产物送至生工生物工程(上海)股份有限公司进行测序,将测序结果与NCBI 数据库进行比对,用JM2023A 株与GenBank 中同源性比较高的米尔伊丽莎白菌属的16S rRNA 序列构建进化树,再用JM2023B 株与GenBank 中同源性比较高的克雷伯菌属的16S rRNA 序列构建进化树结果见图4、图5。JM2023A 株与米尔伊丽莎白菌聚为一支,JM2023B株与肺炎克雷伯菌聚为一支。
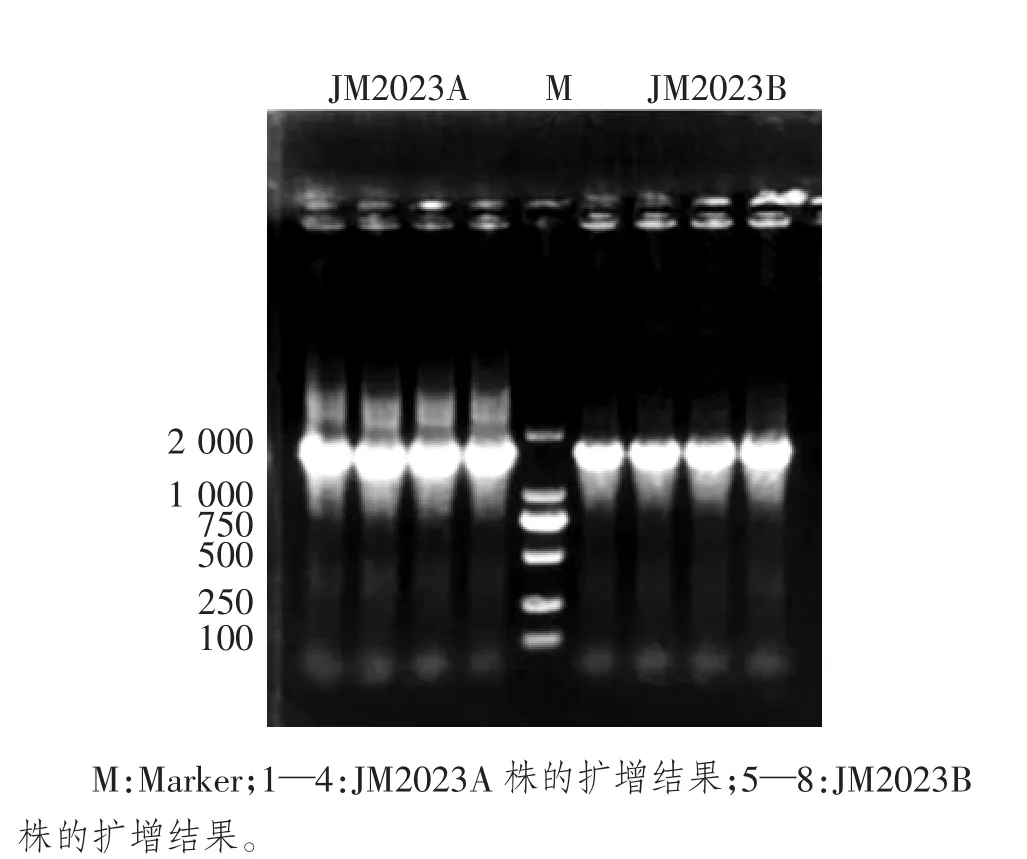
图3 JM2023A 株和JM2023B 株的扩增结果
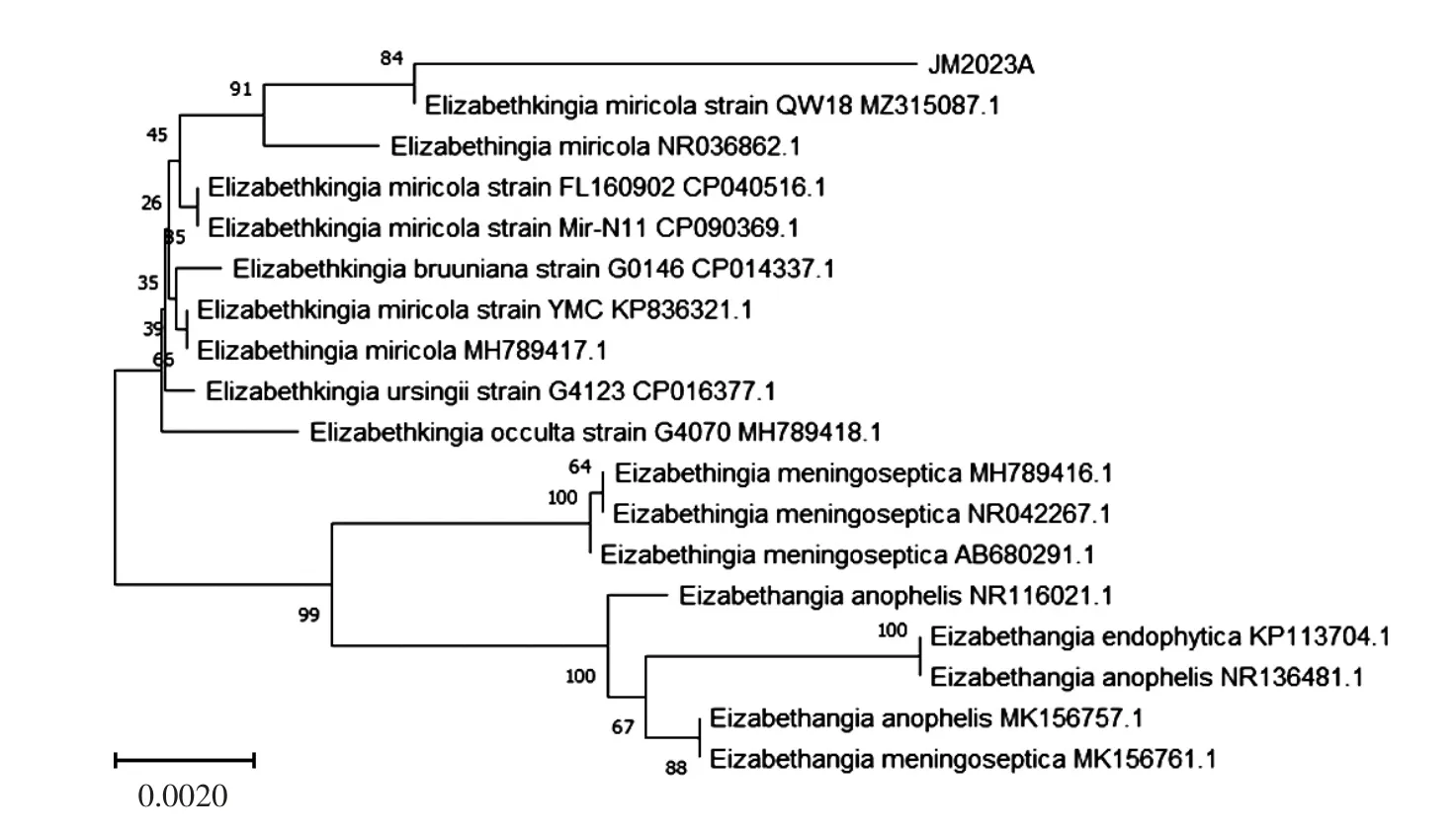
图4 JM2023A 株的16s rRNA 基因序列系统发育树
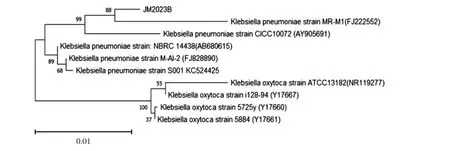
图5 JM2023B 株的16s rRNA 基因序列系统发育树
3.2.2 生理生化鉴定
利用细菌微量生化鉴定管,对分离株JM2023A株和JM2023B 株进行生化指标测定,结果见表1。数据比对见细菌系统鉴定手册[9]。由表1 可见,分离株JM2023A 株的生化指标与米尔伊丽莎白菌一致,分离株JM2023B 株的生化指标与肺炎克雷伯菌一致。结合JM2023A 株和JM2023B 株的理化特性与基因分析结果,综合判定JM2023A 株为米尔伊丽莎白菌,JM2023B 株为肺炎克雷伯菌。
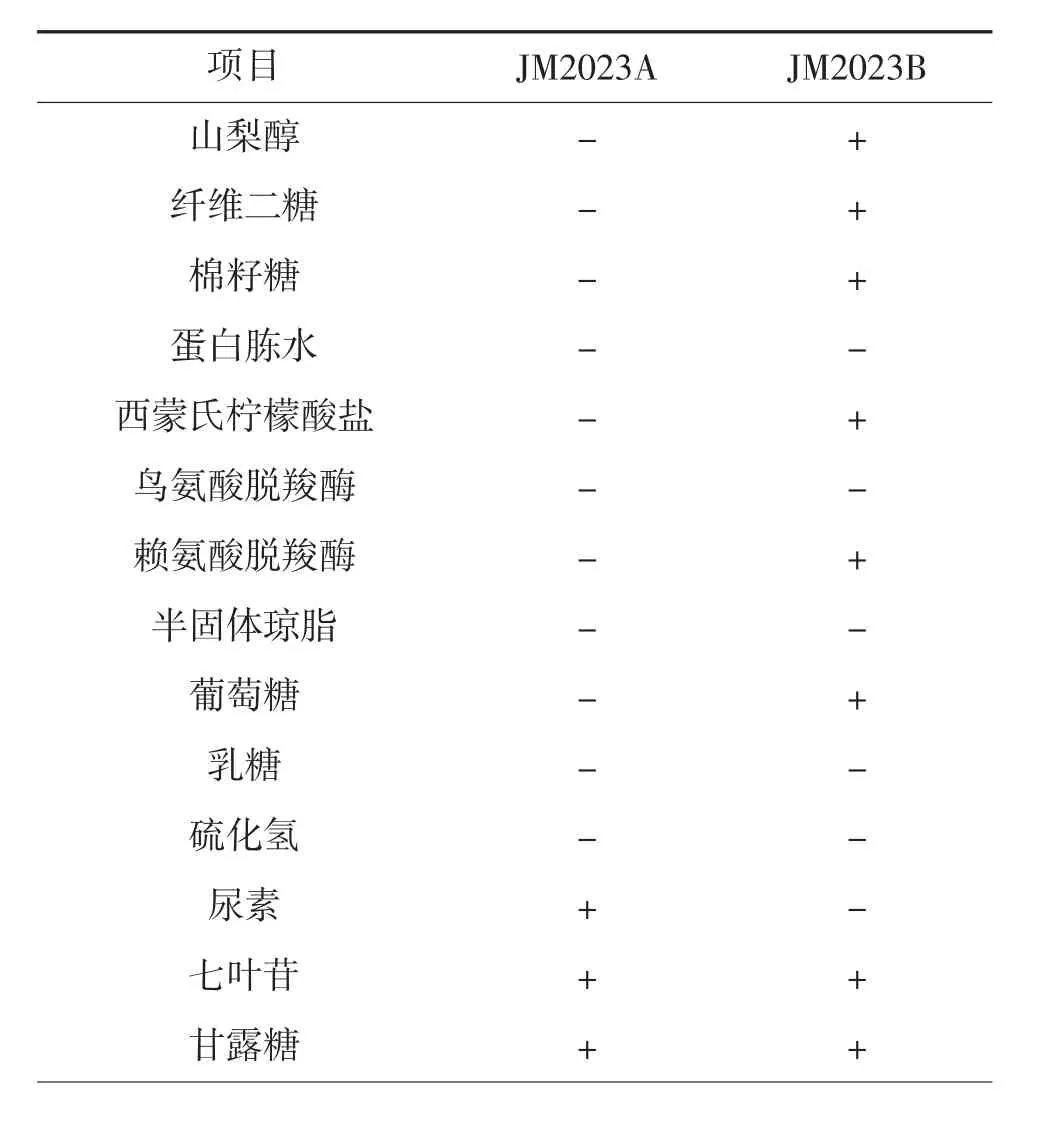
表1 JM2023A 株和JM2023B 株的生化鉴定结果①
3.3 药敏试验
对30种药物进行药敏试验,结果见表2。由表2可见,JM2023A 株对多黏菌素B 敏感;对多西环素、头孢曲松、头孢呋辛、头孢拉定、哌拉西林中度敏感;对其他抗生素表现为耐药。JM2023B 株对头孢他啶、头孢呋辛、哌拉西林中度敏感;对其他抗生素表现为耐药。
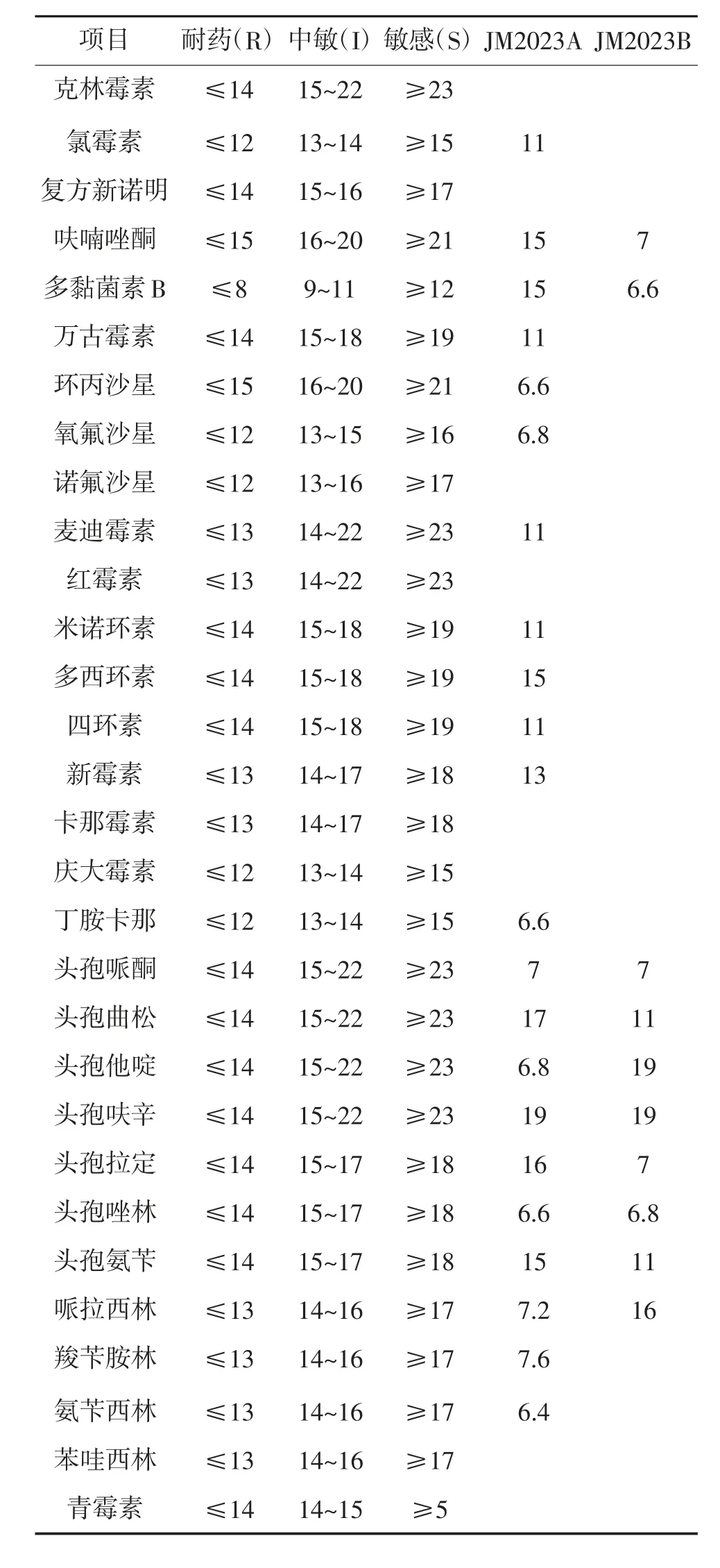
表2 JM2023A 株和JM2023B 株的药敏试验结果 mm
3.4 动物回归试验
将注射JM2023A 菌悬液的命名A 组,注射JM2023B 菌悬液的命名B 组,注射JM2023A 和JM2023B 混合菌悬液的命名C 组,注射无菌PBS 缓冲液的命名D 组。试验中,A、B、C 3 组的牛蛙均出现不同程度死亡,A 组蛙出现皮肤变黑、头向一侧歪斜、在水中旋转、眼睛表面出现白色薄膜、食欲下降等症状,死亡率70%;B 组蛙出现眼睛表面出现白色薄膜、厌食懒动,应急能力差、身体失去平衡等症状,死亡率15%;C 组蛙出现皮肤变黑、眼睛表面出现白色薄膜、厌食懒动、游动时身体打转、应急能力差等症状,死亡率90%;而D 组未见患病蛙或者死亡蛙,试验结果见表3。从A 组感染发病牛蛙组织中再次分离出的病原菌经鉴定为米尔伊丽莎白菌,从B 组感染发病牛蛙组织中再次分离出的病原菌经鉴定为肺炎克雷伯菌,从C 组感染发病牛蛙组织中再次分离出的病原菌经鉴定为米尔伊丽莎白菌和肺炎克雷伯菌。可见本次回归试验符合科赫氏法则。
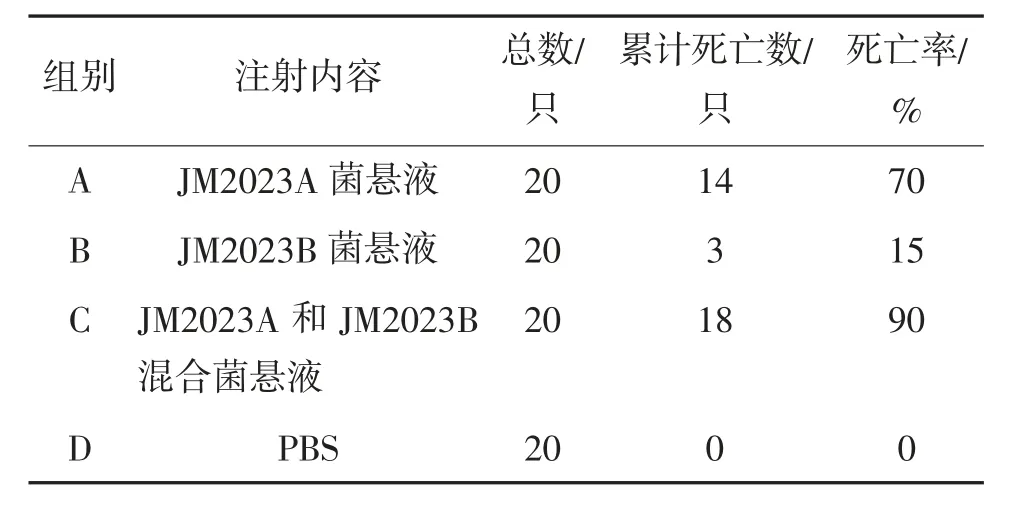
表3 动物回归试结果
4 讨论
近年来,养殖户为了追求高额利润加大了养殖密度,使水体承载能力加大,同时也加大了投饵率,导致水体受到严重污染,各种病害微生物大量繁殖,温度升高,导致各种病害加大,如蛙的歪头病、白内障病、红腿病、腹水病等[10],其中歪头病、白内障病是近年来养殖蛙类危害最大的病害之一。
本试验从患病牛蛙内脏中分离纯化出2 株疑似菌,通过观察菌落形态、革兰染色、药敏试验、生化鉴定、16S rDNA 基因检测、构建分子进化树等,鉴定为米尔伊丽莎白菌和肺炎克雷伯菌,回归试验感染后,可见引起歪头和白内障等症状,证实了2种菌可引起牛蛙歪头白内障病。
药敏试验结果显示,米尔伊丽莎白菌株对多黏菌素B 敏感;对多西环素、头孢曲松、头孢呋辛、头孢拉定、哌拉西林中度敏感;对其他抗生素表现为耐药。肺炎克雷伯菌株仅对头孢他啶、头孢呋辛、哌拉西林中度敏感;对其他抗生素表现为耐药。2 个菌株均具有较强的耐药性,肺炎克雷伯菌的药敏试验结果,与周蓉等[11-12]的试验结果差异较大。可见不同地区肺炎克雷伯菌耐药性有一定的差异,原因可能是不同地区临床中用于治疗肺炎克雷伯菌引起的疾病,常用药物存在差异导致,同时表明,肺炎克雷伯菌的耐药性在增加,可能是由于抗生素使用不当引起。这种变化趋势,对该菌的临床治疗和控制带来了巨大的挑战,建议在临床防治牛蛙歪头白内障病时,不选用农业农村部明令禁止使用的氯霉素、呋喃唑酮等药物[13],并且依据药敏结果,选择合适的抗生素,采用交叉及联合用药等方式,避免滥用抗生素,加强临床用药监管,以降低细菌的耐药率[14]。同时视情况可以考虑采用非抗生素依赖性手段,例如疫苗。据周永灿等[15]的研究结果,接种白内障病蛙中分离的病菌制备的灭活疫苗,对有效预防该病的发生确实具有十分良好的效果。
动物回归试验结果显示,A、B、C3 组菌液在注射试验蛙后,同样出现了白内障,歪头等现象,且都具有一定的致病性,但程度不同。确定了米尔伊丽莎白菌和肺炎克雷伯菌是其致病菌,也确定了江门市某牛蛙养殖场疾病暴发的主要原因,是感染了细菌性病原菌。A 组注射米尔伊丽莎白菌液的试验蛙死亡率70%;B 组注射肺炎克雷伯菌液的试验蛙死亡率15%;C 组注射米尔伊丽莎白菌和肺炎克雷伯菌混合菌液的实验蛙死亡率90%;而D 组注射PBS未见患病蛙或者死亡蛙。可见米尔伊丽莎白菌和肺炎克雷伯菌均可导致牛蛙患歪头白内障病死亡,其中米尔伊丽莎白菌为主要致病菌。而米尔伊丽莎白菌和肺炎克雷伯菌共同致病时,死亡率相较于2 个菌单独作用时,有明显升高趋势。本试验结果表明,2种菌共同致病时,有协同作用。建议在临床上,选择对2种菌均有效的治疗方案。
5 结论
通过菌落形态、生化特性、基因序列、药敏性、致病性等方面试验,分离得到病原菌,确定了江门市某牛蛙养殖场牛蛙歪头白内障病的病原为米尔伊丽莎白菌和肺炎克雷伯菌。2种菌均对多数抗生素耐药,共同致病时,具有协同作用,对牛蛙具有比各自单独致病时更高的致死率。
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊",将会定期向你推送信息!

