论文:鲢早期发育对过饱和总溶解气体响应与仔鱼耐受性的研究
鲢早期发育对过饱和总溶解气体响应与仔鱼耐受性的研究
杨传顺,吴湘香,杜开开,柳 凌,茹辉军,张 燕,倪朝辉,李云峰
(1.上海海洋大学,上海 201306;2.中国水产科学研究院长江水产研究所,农业部长江中上游渔业生态环境监测中心,武汉 430223)
高坝泄水时,大量气体被卷入水体深处使水体中的溶解气体(主要包括溶解氧(DO)、溶解氮(DN))过饱和,称为水体总溶解气体(TDG)过饱和[1]。这些过饱和水体流入下游河道后,沿程并不会很快释放出来[2],使得生活在其中的水生生物长期处于溶解气体过饱和的环境中,导致鱼类患气泡病,影响鱼类生理及繁殖[3]。
国外关于TDG过饱和水体对鱼类影响的研究开展较早[4,5]。早在1905年Marsh和Gorham就第一次具体地描述了气栓在鱼类血液循环系统的形成过程和危害程度[6]。20世纪60年代,哥伦比亚斯内克河(Columbia and Snake River)修建了大量蓄水和发电的高坝,在汛期高速下泄的河水卷入大量的气体,导致大坝下游溶解性气体达到过饱和状态,造成了鱼类尤其是大马哈鱼、虹鳟大量死亡[7-9]。Weitkamp等[10]研究发现在1997—2000年汛期期间,Clark Fork河下游TDG饱和度最高达到150%,导致当地鱼类患上严重的气泡病。还有研究表明鱼类在不同的生长阶段对气体过饱和的忍耐性是不同的[11-14]。
在国内,随着长江上游河流梯级开发,高坝密集建设,水体溶解气体过饱和问题越来越严重,TDG过饱和水体严重威胁到了坝下游水生生物尤其是鱼类的生存[2]。针对长江中上游TDG过饱和对鱼类的影响,国内开展了一系列[15-20]研究。董杰英等[21]发现四大家鱼暴露在溶解气体过饱和的环境中容易出现眼球突出、鳍充血和身上出现气泡等一系列气泡病症状。梁瑞峰等[22]研究发现孵化率会随总溶解气体饱和度的升高而降低,较高的总溶解气体饱和度能加快其孵化速率。长江中上游水电工程开发所带来的TDG过饱和问题,不仅使长江主要经济鱼类及珍稀保护鱼类的生存面临挑战,而且也对鱼类的早期资源量产生严重的影响。本研究以中上游主要经济鱼类——鲢(Hypophthalmichthysmolitrix)为对象,通过研究TDG过饱和水体对鲢早期生活史的影响及耐受性,以丰富TDG过饱和水体对鱼类早期发育影响的资料,同时也为高坝下游生态保护措施的制定提供借鉴。
1 材料与方法
1.1 实验材料来源
实验用鲢受精卵取自中国水产科学研究院长江水产研究所窑湾试验场,从产卵池的集卵箱一次采集3 000~5 000粒卵,放入盛有产卵池水的塑料箱中,随即转运至实验室的养鱼池中,准备实验用。
实验用幼鱼同样取自长江水产研究所窑湾试验场,分别在鲢水花下塘后第15、25、35、45和120天的鱼种塘拉网获得。每次取5 000尾左右的幼鱼迅速转运至实验室的水泥池(水体约2 m3)中暂养。暂养水是经过曝气的井水,水温为18.2~21.4 ℃,溶解氧(DO)浓度为7 mg /L。暂养3 d后挑选出规格一致、体表完整、体质健康个体准备实验。
1.2 不同浓度TDG水的制备
实验装置包括模拟高坝泄水生成TDG过饱和水的试验系统(专利号ZL 2017 2 0786771.7)如图1,主要包括水泵、蓄水池、压力罐、空压机、管道等部件。
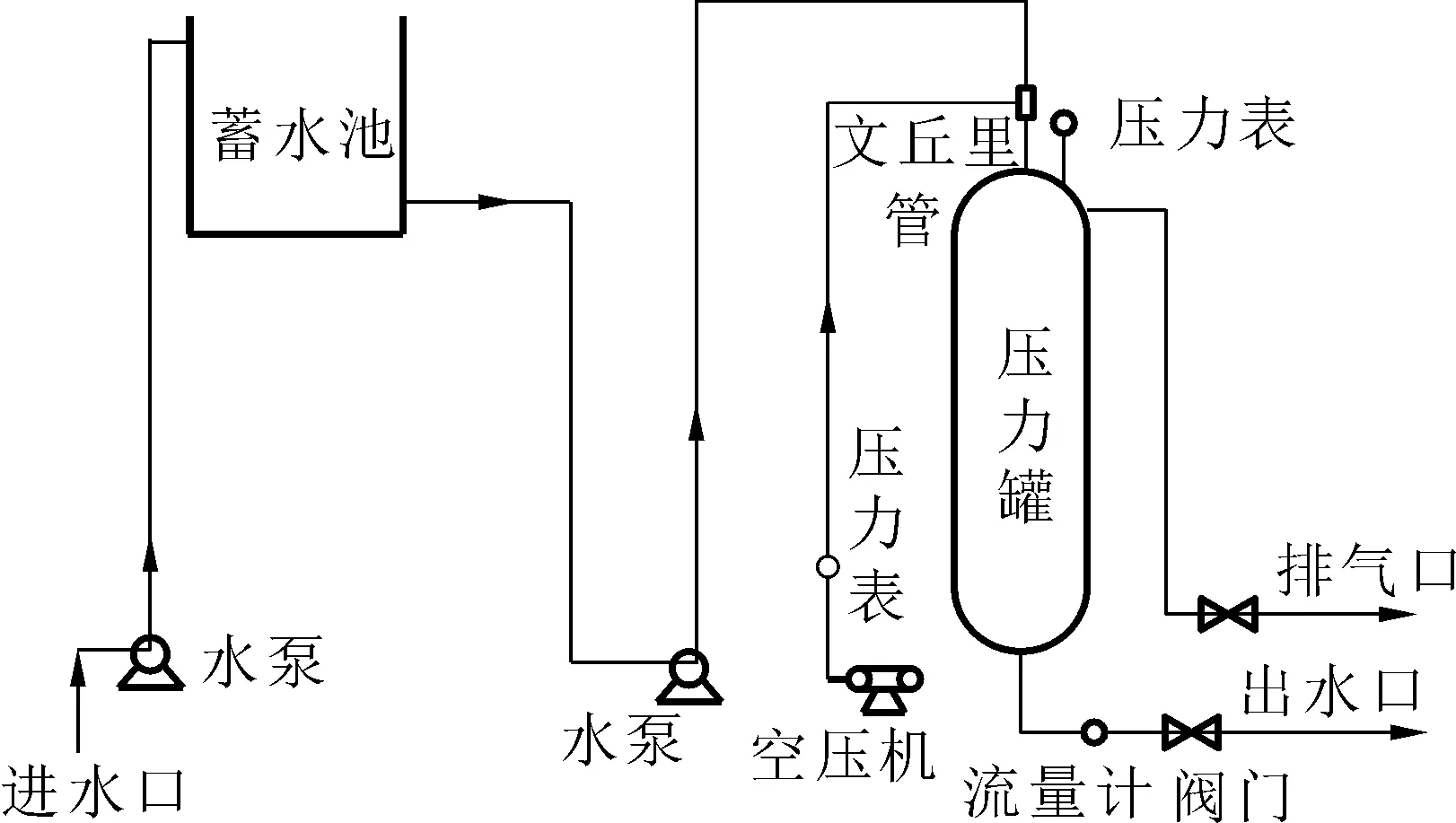
图1 过饱和水发生装置Fig.1 Schematic of an experimental system
过饱和水的产生:空压机向压力罐中打入一定量的空气后,打开水泵向压力罐中泵入一定量的水,泵入的水通过文丘里管使水流分流,增大水体与气体的接触面积,使水体快速与空气混合。进水量一定时,通过调节出水口出水量的大小保持压力罐罐内一定的压强,产生高饱和度的水体,将生成的高浓度过饱和水体与正常水通过控制流量以不同比例混合,可同时产生不同饱和度的水。实验过程中,保持鱼卵塑料箱或者实验池的水体积一定,以一定的速率向鱼卵塑料箱或者实验池加入高饱和度的原水且等流量的溢出相同体积的水体,以此维持饱和度相对稳定,实验用水是井水,温度基本稳定。实验过程中每隔2 h用TDG仪器进行测量和记录,并根据测量的情况随时对饱和度进行及时调节,保证实验饱和度的相对稳定。本实验过程中TDG饱和度的测定选用丹麦Oxyguard公司生产的Handy Polaris TGP(Total Dissolved Gas Pressure)测定仪,其量程为0~200%,其精度为±1%。
1.3 实验方法
1.3.1 受精卵孵化实验
将准备好的鲢受精卵分别放入加有不同TDG饱和度水体的塑料箱中,箱底部有一个直径20 mm的进水口,箱顶部有两个溢水口,每个塑料箱约含0.25m3的水体,放入约300粒左右的受精卵。试验饱和度分别设定为110%,120%,130%和140% 4个试验组,每个试验组4组平行。对照组用水采用调制的井水,饱和度为80%。试验期间的孵化水温控制在(21±0.5)℃。
试验开始后,按事先设定好的不同发育时期,即原肠晚期、脊索形成期、心跳期和尾芽期,从各试验组中随机挑选20粒左右的受精卵置于10倍的体视镜(型号SZ61,生产厂家奥林巴斯)下观察胚胎发育情况,记录被观察卵的数目和畸形数。孵化约35 h后,每隔0.5 h,观察各试验组和对照组的出膜情况,记录出膜幼苗数和出膜时间。
待出膜完成后,对各试验组和对照组换一次水,同时挑出死卵,继续观察幼苗的胚后发育情况。每天统计各组的死亡数量并记录相应的死亡时间,直到仔鱼平游之前。
1.3.2 不同阶段的幼鱼暴露实验
将暂养3 d,经过挑选的试验用幼鱼,放入架设在灌有不同浓度TDG水的不锈钢圈支撑的圆柱形网箱(直径100 cm、高50 cm)中。15、25、35、45 d发育的鲢幼鱼每个圆柱形网内放入200尾左右,120 d发育的鲢幼鱼每个圆柱形网内放入50尾左右。每个饱和度组设4个平行组,水温(21±0.5)℃。连续观察96 h,记录各试验组中鱼的活动及死亡情况,若出现死亡,记录死亡时间和死亡数量。
1.4 数据整理
实验数据采用SPSS21软件进行方差分析,并采用Duncan多重比较进行差异显著性分析(P<0.05)。
2 结果
2.1 过饱和水体对鲢受精卵孵化的影响
不同TDG饱和度下对鲢受精卵孵化的影响结果见表1。从表1中可以看出,各试验组在发育过程中均有一定程度的畸形率,与对照组比较差异不显著。出膜率最高是过饱和110%试验组,其平均出膜率达到了92.3%,与对照组比较存在显著差异。

表1 不同TDG饱和度下鲢受精卵孵化的影响Tab.1 Effect of various TDG supersaturation levels on silver carp fertilized eggs incubationin different experimental groups
受精卵孵化的出膜时间和数量统计结果见图2。图2显示,(21±0.5)℃温度下,试验组受精卵出膜峰值时间较对照组出现不同程度的提前,但过饱和110%试验组出膜时间最早,出现在38.5 h左右,而同一温度下,对照组出现在41.5 h左右,随着试验过饱和浓度升高,受精卵出膜的峰值时间逐渐接近对照组。

图2 不同TDG饱和度下鲢受精卵出膜率与时间的关系Fig.2 Relationship between hatching rate and exposure time
对出膜后的幼体进行胚后发育观察的结果见表2。从表2可看出,在(21±0.5)℃温度下,无论试验组还是对照组都经历了5 d左右的胚后发育,发育时间和发育速度均无明显差异。
从表2可看出,试验组存活率均比对照组低,存在显著性差异,130%试验组与140%试验组没有显著性差异。试验组120%、130%和140%的最后存活率高于试验组110%,且随着饱和度的增加,存活率会稍微升高。各试验组幼苗的死亡主要集中在出膜后第2~3天。110%试验组在出膜第2天的平均死亡率为13.6%,第3天的平均死亡率为13.7%,均明显高于其他组。

表2 不同TDG饱和度对鲢幼苗的影响Tab.2 Effect of various TDG supersaturation levels on silver carp fries in different experimental groups
注:n=4,凡有相同字母的表示差异性不显著,反之则表示差异显著。
上述研究结果表明水体的过饱和对鲢受精卵的发育速度和畸形率没有明显的影响,但110%试验组显著提高了受精卵的出膜率,同时提早了受精卵的出膜时间。其它试验组虽然在出膜时间和出膜率上与对照组比较有一定的差异,但无显著性差异,因此表明高饱和度的水体对受精卵的出膜率和出膜时间均无影响。对胚后发育的观察发现,与对照组比较各种饱和度的水体均能导致胚后发育幼苗的存活率降低,幼苗死亡的时间主要集中在出膜后第2天和第3天。
2.2 不同生长阶段的鲢幼鱼对过饱和气体的耐受性研究
不同生长阶段的鲢幼鱼对不同TDG饱和度耐受性的结果见图3。从图3可以看出,不同生长阶段的鲢幼鱼对不同饱和度水体的耐受性存在差异。图3(a)和(b)显示了15和25 d的鲢幼鱼在不同饱和度水体中的耐受性。结果表明15和25 d鲢幼鱼在各试验饱和度水体中死亡率很低,与对照组几乎无差异。96 h后15和25 d的鲢幼鱼总死亡率分别为2.5%和5.0%。因此,不同饱和度水体对15和25 d的鲢幼鱼存活率几乎无影响。图3(c)显示了35 d鲢幼鱼在不同饱和度水体中的耐受性。结果表明110%试验组中鲢幼苗的总死亡率与对照组比较无显著性差异。但120%,130%和140%试验组中鲢幼苗均出现了较高的死亡率,且TDG饱和度越高,死亡率也越高,96 h后3个试验组的总死亡率分别为19.1%、21.0%和25.0%。由此可见,对于生长35 d的幼苗TDG饱和度越高,死亡率也越高,最高可达到25.0%。图3(d)和(e)显示了45 d和120 d鲢幼鱼在不同饱和度水体中的耐受性。从图中可以看出,随着鲢幼苗在TDG过饱和水体中暴露时间的延长,其死亡率也会相应增加,并且随着TDG饱和度的增加,死亡率相应增加。96 h后两个实验组总死亡率为60%~100%。
综上所述,鲢幼苗在生长25 d前,对TDG不敏感,几乎不受TDG饱和度影响。生长到35 d时,低饱和度的TDG对幼苗仍然没有影响,但120%以上的高饱和度TDG对幼苗会产生一定程度的影响,导致幼苗死亡率随TDG饱和度升高而增加。45 d后到120 d的鲢幼苗,对TDG过饱和水体非常敏感,各饱和度的TDG均能导致鲢幼苗迅速死亡,但各饱和度的TDG对鲢幼苗死亡率的影响有一定差异。幼苗死亡均发生在暴露7 h左右,暴露96 h后,45 d的死亡率在60%~81%,120 d的死亡率为86%~100%。

图3 不同阶段鲢暴露时间和死亡率关系(a-e分别表示:15、25、35、45、120 d)Fig.3 Relationship between exposure time and mortality in different stages of silver carp
3 讨论
3.1 TDG对鲢受精卵孵化的影响分析
有学者研究认为TDG在一定饱和度下对有些鱼类的受精卵发育是有影响的,Meekin等[12]发现当气体饱和度达到112%时,在同一个孵化场内虹鳟鱼卵发生了严重的死亡,但大鳞大马哈鱼鱼卵却没有受到影响。郝思平等[23]也发现,溶氧量越高,在某些情况下,孵化期内胚胎死亡率下降[24]。但Marsh等[11]和许多学者均报道了过饱和水体对鱼卵的孵化不会产生影响且不会导致气泡病的发生。本研究结果表明,温度稳定的情况下,水体TDG过饱和对鲢受精卵的发育速度和畸形率没有显著影响,且没有发现受精卵得气泡病。鱼的胚胎发育是一个耗氧过程,有充足的氧可以保证胚胎的正常发育,有利于孵化率的提高。本研究的结果与Marsh等[11]的研究结果基本一致。
本研究发现,当TDG饱和度在110%时,对受精卵的出膜率和出膜时间均有显著性的影响,它有效提高了受精卵的出膜率和出膜时间。Oppenberntsen等[25]试验表明低氧环境下,大西洋鲑胚胎的孵化时间比高氧环境情况下短。Rombough[26]研究也认为当受精卵内氧气供应不足时,仔鱼迫于氧气的需求提前孵化而保证生存,但畸形率会提高,导致孵化率下降。因此,推测110%试验组的提前出膜与受精卵内低氧环境有关。由于过饱和气体极易在受精卵膜表面吸附一层空气泡,部分阻断了卵内外的水体交换,使卵内的氧气含量降低,造成受精卵处在一个低氧环境,从而使受精卵提早出膜。但是提早出膜的鲢幼体缺乏保护,极易受到损伤,因而各种TDG饱和度中的幼体存活率与对照组比较均降低了,且出膜越早存活率越低。这个结果与Rombough[26]的研究结果是一致的。
3.2 不同生长阶段的鲢幼鱼对过饱和气体的耐受性分析
已有研究表明鱼类在不同的生活阶段对于气体过饱和的忍耐性是不同的[11-14],Meekin等[12]报道随着大鳞大马哈鱼年龄的增长,对于溶解性气体的忍耐性却逐渐降低,死亡时间也逐渐缩短。Rucker[13]用不同体长的银大马哈鱼进行了实验研究,结果显示体长小(40 mm)的鱼比体长大(53 mm、67 mm)的鱼对于气体过饱和水体具有更强的耐受性。Counihan等[14]进行了高首鲟在个体发育过程的不同阶段气泡病发生的研究,结果表明孵化后6 d内,发育时间越长,对气体饱和度的耐受性越弱。梁瑞峰等[22]研究了过饱和TDG对重口裂腹鱼生长、繁殖的影响,结果表明孵化后相同发育日龄的重口裂腹鱼对过饱和水体的耐受性随着饱和度的增加而降低。Smiley等[27]发现,暴露在122%饱和水体中,成龄鲈在23 ℃和18 ℃水体中的死亡率比幼龄鲈鱼高20%。
本研究中鲢幼苗在生长25 d前,对TDG不敏感,几乎不受任何饱和度TDG影响。生长到35 d时,低饱和度的TDG对幼苗仍然没有影响,但120%以上的高饱和度的TDG对幼苗产生了一定程度的影响,导致幼苗死亡率随TDG饱和度升高而增加,跟梁瑞峰等[22]研究的结果基本相似。45 d后到120 d的鲢幼苗,对各种饱和度的TDG都非常敏感,各种饱和度的TDG均能导致鲢幼苗迅速死亡,且饱和度越高死亡率也越高。这些研究结果与梁瑞峰等[22]、Smiley等[27]的研究结果基本一致。
分析认为早期幼苗在各种饱和度水体中的死亡率都比较低,随着个体发育各个饱和度的死亡率开始升高,这可能由于鱼类发育过程中呼吸方式的改变所致。鱼类的呼吸方式主要包括水呼吸和气呼吸,是鱼类对生活环境和生活方式的适应。鱼类的呼吸器官有主要呼吸器官和辅助呼吸器官之分,前者是鳃,绝大部分鱼类通过鳃进行水呼吸,但一些鱼类为了适应特殊的生活条件还通过皮肤、鳃上器官、肠管、口腔黏膜、鳔、气囊等辅助呼吸器官进行气呼吸[28,29]。鱼类的呼吸器官在仔鱼孵化后一段时间才发育完善,在此之前,气体交换通过体表皮肤、鳍褶和卵黄囊上丰富的血管直接与水接触来进行[29]。早期阶段鱼类气体通过体表皮肤、鳍褶交换,这些组织可能对TDG不敏感,因此降低了TDG对其本身的伤害。随着发育时间的延长,呼吸方式开始改变,其对TDG的敏感度不断上升。Hughes[30]发现,活跃鱼类的鳃丝数、鳃丝长、鳃小片密度大于中等活动性鱼类和活动迟钝鱼类,但活跃性鱼类的单个鳃小片面积小于缓慢性鱼类,这可能是因为活跃性鱼类代谢速率和能量需求较高,需要较大的交换面积,但较小的鳃小片对水的阻力较小,符合其对快速活动的要求。同种但不同规格鱼类的呼吸面积也有所不同,一般鳃丝数量、长度、单个鳃小片面积、总呼吸面积随体质量的增加而增大,鳃小片密度、相对呼吸面积随体质量的增加而减小,其中单侧鳃丝数、总鳃丝数与体质量呈对数关系,鳃小片数、单个鳃小片面积、总呼吸面积及相对呼吸面积与体质量呈幂指数关系[31,32]。从生活环境看,鲢喜居于水的中上层,是属于活跃鱼类。随着其发育的时间的增长,呼吸器官不断完善,呼吸方式慢慢转变。当其基本发育完全时,由于其鳃的构造等导致其气体交换比较快,对于高压下的高溶解气体环境产生强烈不适应,因而表现出对气体过饱和水体较为敏感,导致其随着发育时间的延长,在过饱和水体中的死亡率升高。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

