鲢对藻类摄食效应的室内模拟研究
鲢对藻类摄食效应的室内模拟研究
王 玺1,2王斌梁1,2夏春香1毕永红1陈 磊1,2,3胡征宇1
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 中国长江三峡集团公司枢纽运行管理局, 三峡工程鱼类资源保护湖北省站点实验室, 宜昌 443133)
为研究鲢(Hypophthalmichthys molitrix)对藻类的摄食作用, 采用小环藻(Cyclotella)、小球藻(Chlorella)、微囊藻(Microcystis)和东湖原水开展了小规格鱼种的养殖试验, 对鲢摄食和排泄物进行了研究。结果显示: 在3种纯培养藻种投喂下鲢存活率从高到低依次是小环藻组>小球藻组>微囊藻组; 相应地, 鲢对藻的平均摄食率排序也是小环藻组>小球藻组>微囊藻组。在显微镜下观察粪便发现大部分小环藻为空壳, 一部分小球藻外部形态结构不完整, 外部形态完整的小球藻则色泽暗淡、内部结构紊乱, 微囊藻没有明显变化; 3种藻类细胞的受损率分别为20.04%、7.13%和1.97%。叶绿素荧光活性显示, 粪便中小环藻基本失去光合活性, 小球藻活性极显著降低(P<0.01), 微囊藻活性明显降低(P<0.05), 东湖原水处理组光合活性较对照极显著降低(P<0.01)。对东湖水饲喂试验组排泄物的检测发现, 浮鞘丝藻Planktolyngya、鱼腥藻Anabeana(有破损)、假鱼腥藻Pseudoanabaena和颤藻Oscillatoria细胞受损严重; 空星藻Coelastrum和盘星藻Pediastrum细胞部分破损; 针杆藻Synedra、小环藻、桥弯藻Cymbella和舟形藻Navicula多为空壳。鱼粪中平裂藻Merismopedia、微囊藻、浮鞘丝藻、鱼腥藻、颤藻、卵囊藻Oocystis、栅藻Scenedesmus和衣藻Chlamydomonas在重新培养后恢复了生长。本研究显示硅藻尤其是小环藻、针杆藻和舟形藻对鲢摄食最敏感; 栅藻、卵囊藻和平裂藻对摄食压力不敏感。研究表明鲢捕食对藻类群落结构有明显的改变效应, 利用鲢的滤食进行藻类群落调节和水华防控具有可行性。
藻类; 浮游植物群落; 种群; 鲢; 摄食率
当前富营养化已经成为影响水体环境质量的主要难题[1]。近十几年来, 我国几乎所有的江湖河海和局部地下水或多或少遭受氮磷污染[2], 富营养化趋势显著。水体的富营养化会引发藻类暴发性增殖(水华), 水中溶解氧降低, 水生生物大量死亡, 水生生态系统紊乱, 进而影响城市供水、景观旅游和水产品养殖业等。治理水体富营养化根本上是要解决其中的氮磷等营养盐负荷过高的问题[3], 采取的方法可分为物理方法、化学方法和生物方法等。物理方法相对安全但运行成本高、难以高效除藻; 化学方法中使用的化学试剂效果显著但易造成二次污染;生物方法是指利用食物链传递过程使得营养盐得到降解和转化, 该净化技术具有环保低耗的特色。20世纪 70年代 Shapiro等[4]提出生物操纵的概念, 80年代有学者提出了利用鱼类下行作用模型及生物操纵来防治湖泊富营养化[5]; 生物操纵的核心内容是利用浮游动物控制藻类[5], 我国科学家对鱼类与水域环境间的关系也有大量研究[6,7], 谢平[8]提出的利用鲢鳙控制蓝藻技术称之为非经典生物操纵。
非经典生物操纵在湖泊富营养化的治理上已取得一定效果。谢平等[9]在对武汉东湖的围格实验表明鲢鳙鱼对微囊藻有显著地抑制作用。并且在巢湖、滇池、千岛湖和山东东周水库等水污染治理中, 这项应用也展现了较好的研究成果[10—12]。但另有研究发现, 在较浅的水域中, 随着滤食性鱼类的摄食活动和生理代谢的增加, 促进了氮磷的释放反而有利于浮游植物的增长[13]; 并且还有研究认为鱼类对大型浮游植物的摄取导致浮游植物整体趋于小型化,微型浮游生物比重显著增加[14]。研究认为利用鲢鳙控制水华的成功与其放养的时间和密度有重大关系[14]。法国的 Domaizon等[15]发现低密度放养白鲢时叶绿素含量较低, 随着密度增大叶绿素含量也增高。在波兰的Wamiak湖中放养鲢的密度为30—90 g/m3时,浮游植物生物量和蓝藻比例明显减小[16]。刘建康等[9]提出东湖放养鲢的密度在46—50 g/m3以上, 能够显著控制微囊藻的增殖。而 Domaizon等[15]实验表明鲢的放养阈值为26 g/m3, 超过则反助于小型藻的暴发性滋长。另外浮游植物的沉降速率很低, 在浅水中由于鱼类的活动其沉降更慢; 并且鱼类也会排泄氮磷等营养物质到水体中, 这可能引起水体初级生产的增加[17]。
利用滤食性鱼类控制藻类的技术实行结果具有较大差异, 与实验条件、放养密度及具体水域实际情况有关。为深入探明生物操纵的作用, 本研究直接从滤食性鱼类本身的摄食效应出发, 考察滤食性鱼类对藻类种群与群落的处置效果, 确认生物操纵对修复生态环境的实际效果。
1 材料与方法
1.1 试验材料
试验所用鲢鱼种购自湖北省鄂州市保安湖扁担塘东风农场。试验前鱼苗先在室温22℃下暂养3d。之后选择体重相当的鱼种, 暂养在曝气自来水的水族缸(130 L)中饥饿处理2d, 待鱼肠清空并称重作为研究材料。试验所用藻类(微囊藻、小环藻和小球藻)均来自于中国科学院水生生物研究所藻种库, 试验时选择稳定生长期的藻细胞来投喂鱼类。
1.2 鱼种存活率及排泄物观察
试验前离心收集藻细胞, 加入到10 L的玻璃水族箱中调节水体中的藻类密度, 定期镜检确定水族箱的藻类细胞密度; 每个处理组设置 3个重复和 3个对照组。微囊藻(Microcystis aeruginosa)密度为928.5×105cells/L, 小环藻(Cyclotella)密度为726.3× 105cells/L, 小球藻(Chlorella)密度组为822.8×105cells/L。3种处理组的水族箱里分别饲养 50条鱼种(体重0.254—0.272 g, 平均体长为2.6 cm)通气培养。3个对照组细胞密度与试验组相同, 全部对照组未放入鱼种。温度控制在22℃左右, 光照强度45 μmol/(m2·s)。每天记录鱼种存活数量, 10d后从水族箱移出并称重。收集鱼粪, 4000 r/min下离心。称量0.1 g蒸馏水稀释到1 mL。在显微镜下统计完整的藻细胞数与非完整的藻细胞数。
1.3 藻细胞的摄食率
试验前离心收集藻细胞, 加入到 8 L的玻璃水族箱中调节密度, 设置3个重复组和2个对照组。微囊藻组的密度设定为1.857×106cells/L, 小环藻组的密度为 1.495×106cells/L, 小球藻组的为 1.525× 106cells/L。3种藻及其重复组的水族箱里放养 20条饥饿处理的鱼种(体重 0.225—0.232 g, 平均体长2.6 cm)通气培养。对照组的藻液密度与试验组相同,未放入鱼种。温度控制在 22℃左右, 光照强度低于2 μmol/(m2·s)。5h后将鱼苗移出, 在显微镜下统计藻细胞的密度。
摄食率的计算公式为: I=V×{Ceo–[Ceo×(Cco–Cct)/Cco]–Cet}/W·t
其中V是水的体积, W是鱼的湿重, Ceo和Cet分别为试验组藻细胞的起始和终止时的密度; Cco和 Cct是对照组藻细胞的起始和终止时的密度[18]。
1.4 东湖水喂养鱼种的摄食及排泄
以东湖水注入水族槽中(测定藻细胞密度), 每组10 L (共三组)均等放入 20条小鱼种[总重(4.5± 0.021) g]通气培养。试验期间同等投喂鱼体重 2%的饲料。另设 3组水族箱不加鱼种的东湖水用作对照,试验温度22℃左右, 光照强度10 μmol/(m2·s)。每隔3天测定叶绿素含量。20d后测定水体浮游植物的密度。另设一组10 L东湖水放养10条小鱼种, 不投喂其他饲料, 每3天收集鱼粪用显微镜下观察镜检藻类。
1.5 鱼粪饲喂和再培养
设两组10 L曝气自来水放养的鱼种(10条), 试验前同样饥饿处理 2d。每天按鱼体重的 5%仅投喂前东湖水试验收集的粪便(湿重)。1周后收集粪便再观察。
将收集的鱼粪称重加入到BG11和D1培养液,置于光照培养箱, 光强50 μmol/(m2·s), 12D︰12L光暗周期、22℃的条件下再培养 2周, 观察藻类活性的恢复情况。
1.6 鱼粪的光合活性检测
在清水槽中收集鱼粪离心, 用蒸馏水等倍稀释。分别吸取3 mL样品利用 WATER-PAM(德国)检测最大光化学效率Fv/Fm。
1.7 数据分析
利用数据采用Excel 2013、SPSS 17.0 和origin 9软件进行统计分析和制图, 使用 t-Test、ANOVA统计方法对试验处理组进行统计意义检验。
2 结果
2.1 纯培养微藻饲喂鲢的现存量
由图1可见, 微囊藻试验组的鱼种20d内死亡数量最多, 最终平均现存量为 14条, 平均体重(0.256±0.005) g。小球藻试验组的鱼种20d后存活数平均为18条, 体重平均值(0.26±0.004) g。小环藻试验组的鱼苗20d内死亡数最低, 最终平均现存量19条, 平均体重(0.262±0.006) g。经检验, 微囊藻组的鱼种存活数显著低于其他两组(P<0.05)。并且小环藻组的存活数显著高于小球藻组(P<0.05)。
2.2 纯培养微藻饲喂鲢的排泄物分析
由表1可知不同藻喂养鱼种排泄物中藻细胞的平均密度。其中小环藻密度高达2.66×106cells/g, 小球藻次之, 微囊藻密度相对最低, 仅有1.68×106cells/g。受损细胞比率的检测结果显示, 小环藻在排泄物中的完整细胞数最少, 微囊藻细胞多保持完整形态。由鲢对小环藻、小球藻和微囊藻在水温22℃左右的平均摄食率可知小环藻的摄食率最高。
2.3 东湖水饲养鲢的藻细胞密度
东湖水试验组在 20d后, 密度显著变化。表 2是以东湖水饲养小鱼, 对照组和试验组的细胞密度变化情况。一共鉴定出硅藻7属。试验组的硅藻细胞总密度相比于对照组减少 9.88×105cells/L; 其中小环藻细胞密度最高, 试验组与对照组相比有显著降低(P<0.01); 针杆藻细胞密度与对照组无显著差异; 舟形藻属的密度显著减少(P<0.01)。蓝藻鉴定到9属, 结果显示蓝藻细胞显著减少(P<0.01); 浮鞘丝藻、蓝纤维藻、颤藻和微囊藻的细胞密度降低; 与对照组相比, 蓝纤维藻属、微囊藻属、泽丝藻属和颤藻属的数量有显著性减小(P<0.01)。绿藻有 8属,栅藻、空星藻、盘星藻和卵囊藻的细胞密度与对照组相比有显著降低(P<0.01)。
根据体积转化法推算了试验组的生物量变化量(表2)。生物量显著变化的有针杆藻、浮鞘丝藻、蓝纤维藻、栅藻和盘星藻(P<0.05)。
2.4 鲢排泄物中藻类鉴定与再培养
表3显示的是鱼粪中观察到的藻细胞及其存在状态, 17种藻中浮鞘丝藻的数量高达86.4%, 其次是平裂藻和假鱼腥藻的数量相对较多。平裂藻多保持完整, 假鱼腥藻大多断裂。其他细胞受损率高的藻类还有鱼腥藻、颤藻和盘星藻。硅藻的受损细胞数最高(空壳细胞计入受损细胞数)。
表4是以鲢鱼粪投喂饥饿处理的鱼种后鱼粪收集观察和再培养的结果。一共鉴定到13种藻类。另外粪便再培养后仍观察到10种藻。栅藻和平裂藻的细胞数最高。硅藻暂未发现。鱼粪再培养的生长情况与投喂前收集观察的结果一致。
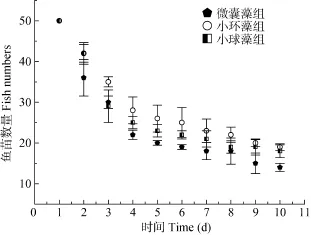
图1 不同微藻饲喂试验组的鱼种存活数Fig. 1 The standing crop of three microalgae feeding groups

表1 纯培养微藻饲喂鲢的排泄物藻类分析Tab. 1 The cell density and digestion in the feces of silver carp fed with different algal species

表2 东湖水饲养鲢的藻细胞密度变化情况Tab. 2 The change in cells density in the aquarium microcosms

表3 东湖水试验组鱼粪中的藻类组成Tab. 3 The species and shapes of the algae in sliver carp feces

表4 鱼粪投喂饥饿鱼种后的粪便收集与再培养情况Tab. 4 The re-collection and re-cultivation of feces discharged by the hungry silver carp fed with feces
采用东湖水饲养鲢的水体浮游植物密度和鲢排泄物的结果显示, 水体中的密度变化显著的有: 小环藻、舟形藻、针杆藻、微囊藻、蓝纤维藻、泽丝藻、颤藻、假鱼腥藻、浮鞘丝藻、栅藻、空星藻、盘星藻和卵囊藻。粪便中完全受损的藻类有浮鞘丝藻、鱼腥藻(有破损)、假鱼腥藻和颤藻; 盘星藻破损的较多, 空星藻有小部分破损; 针杆藻、小环藻、桥弯藻和舟形藻多为空壳。粪便中的栅藻、平裂藻、微囊藻、浮鞘丝藻、鱼腥藻、颤藻、卵囊藻和衣藻在重新培养后恢复了生长。由此可见, 硅藻, 尤其是小环藻、针杆藻和舟形藻对滤食性鱼类的摄食最为敏感。
2.5 藻类光合系统活性
图2为不同微藻以及东湖水投喂鲢前后及其鱼粪再培养液的最大光化学效率(Fv/Fm)。可见, 粪便中的小环藻基本失去活性, 小球藻活性极显著降低(P<0.01), 微囊藻活性明显降低(P<0.05), 东湖原水处理组粪便光合活性较对照极显著降低(P<0.01)。经过再培养的鱼粪, 其光合活性不同程度地恢复; 微囊藻的活性甚至高于投喂前的对照, 小球藻和东湖原水处理组均有较大幅度的活性恢复, 但小环藻的活性恢复能力最弱。

图2 不同处理组饲养鲢的叶绿素荧光活性变化Fig. 2 Variation of chlorophyll fluorescence in different treatment groups
3 讨论
史为良等[17]的网箱实验结果显示, 放养鱼密度大的处理组其优势种多为栅藻、小球藻和蓝纤维藻等; 朗宇鹏等[19]的研究表明鲢对蓝藻生长具有很好的控制力。本试验发现鲢能够有效滤食部分蓝藻。虽然排出的藻类仍有部分活性, 但需要良好的环境条件才能恢复生长; 在自然环境条件下, 鱼粪会吸引浮游动物和原生动物等摄食分解, 进一步增加了其活性恢复和种群复壮的难度。在本研究中投放鱼种的年龄小, 由于试验时间较短, 尽管对藻类物种的影响有限, 但也显示了其对蓝藻生物量的显著改变作用。从这个角度看, 滤食性鱼类能够摄食利用部分蓝藻的结论是正确的。
有研究认为摄食百分比与水体中浮游植物的密度具有一定相关性, 通常密度越大则摄食效果越明显[19]。在本研究的结果中, 投喂鲢的纯培养微藻细胞密度相当, 但摄食却存在显著的差异, 摄食结果并没有显示与藻类密度的相关性, 鲢对硅藻的摄食消化情况好于绿藻和蓝藻。对纯培养微藻饲喂鲢的排泄物镜检发现, 微囊藻细胞受损率最小, 这与之前的研究者所认为的被膜藻类不易被鲢消化[20,21]的结果相同。尽管小环藻的存活数量最高但却大部分是完全空壳细胞, 周洁和林峰[22]曾提到鲢最易消化的硅藻是异端硅藻和舟形藻等, 倪达书[21]列举了硅藻门细胞构成滤食性鱼类的主要食物。在显微镜下常可见硅质壳破损并且正在释放色素的半消化细胞。在东湖原水的饲养试验中, 尽管蓝藻浮鞘丝藻细胞密度最大, 但经过饲养试验后, 盘星藻、蓝纤维藻和针杆藻的生物量变化最大, 也就是它们被摄食利用的最多, 由此可见, 鲢对硅藻的消化利用能力显著地高于蓝藻; 滤食性鱼类的摄食与水环境中的细胞密度并没有明显的相关性, 而是具有物种的特异性。
鲢排泄物观察结果与周洁和林峰[22]的结果相近。从摄食数量和摄食后形态变化情况来看, 纯培养的微藻饲养结果显示了硅藻对摄食最敏感, 蓝藻对摄食最不敏感; 东湖原水饲养的结果显示, 对鲢摄食敏感的蓝藻有假鱼腥藻、浮鞘丝藻和颤藻; 敏感的绿藻有盘星藻。而在滤食性鱼类强大的摄食压力下, 以微囊藻为代表的物种难以被摄食压力破坏而保存了较高的种群数量。卵囊藻的消化情况与水体密度变化并非完全一致。其存在形态较为完整并且在适当的培养条件可以恢复生长, 但水体中的密度却有显著降低, 可能与试验光照及温度控制有关。
大量研究结果均支持滤食性鱼类对藻类增殖的抑制作用[8,9,23—25]。另一些研究则认为, 滤食性鱼类会摄食浮游动物从而减弱了浮游动物对浮游植物的摄食压力, 间接导致浮游植物生物量增加, 并且可能促进小型藻类暴发生长[26—28]。从本研究结果来看,鲢对藻类的摄食能力得到验证, 仅在0.1 mL鱼粪中就观察到 104个数量级以上的藻细胞被摄食。以东湖原水饲喂鱼种发现, 浮游植物细胞密度和生物量明显降低。有人发现引入鲢不能完全控制浮游植物,但会使浮游植物组成发生显著改变, 细胞数量变化并不大[29]。出现这样的情况可能与具体水域有关,试验所采用的水体以及藻类群落的差异可能导致结果略有不同。
1987年有学者发现鲢粪便中的微囊藻在特定培养基上可以生长[30]。Kolmakov等[31]测定了鲫排泄物中活性藻类的生物量及光合效率, 发现微囊藻的生长与光合活性都显著增加。王银平等[32]曾对杂食性鱼类排泄物进行了藻类光能活性研究; 结果表明鱼类摄食对微囊藻生长及叶绿素荧光参数均有显著影响, 并且光合活性和生长活性经过再培养后会逐渐恢复。本试验同样发现摄食排泄后各组的 Fv/Fm值显著变化, 粪便中的微囊藻光合系统活性显著降低, 但再培养后的活性竟然高于对照, 据此推测适度的摄食压力对微囊藻具有刺激作用, 也从另一个角度说明了微囊藻具有较强的摄食抗性, 对其种群调控具有相当的难度; 其他藻类和东湖水光合活性也有不同程度的恢复, 但均难以恢复到对照的水平,尤其是硅藻, 光合活性恢复较困难。由此可见, 经滤食性鱼类摄食后的不同藻类具有不同的恢复能力,这种恢复能力的差异最终将导致水体浮游植物种群动态的显著差别。
[1] ILEC/Lake Biwa Research Institute. Survey of the state of the World’s Lakes [C]. Nairobi, International Lake Environment Committee, Otsu and United Nations Environment Programme. 1993, Volumes I-IV
[2] Lu K H, Yan W J, Su S A. Environmental and ecological engineering on control and remediation of eutrophicated waterbodies: by using ameliorated alum plasma and fishes to control blue- green blooms of qiaodun reservoir [J]. Acta Scientiae Circumstantiae, 2002, 22(6): 732—737 [陆开宏,晏维金, 苏尚安. 富营养化水体治理与修复的环境生态工程—利用明矾浆和鱼类控制桥墩水库蓝藻水华. 环境科学学报, 2002, 22(6): 732—737]
[3] Wang Y, Liu L S, Fang Y D, et al. The research advances about biomanipulation method control of eutrophicated lake [J]. Progress in Natural Science, 2009, 19(12): 1296—1301 [王瑜, 刘录三, 方玉东, 等. 生物操纵方法调控湖泊富营养化研究进展. 自然科学进展, 2009, 19(12): 1296—1301]
[4] Shapiro J, Lamarra V, Lynch M. Biomanipulation: an ecosystem approach to lake restoration [J]. Proceedings ofthe Symposium on Water, 1975, 21(6): 85—96
[5] Liu E S. Analysis on biomanipulation, non-traditional biomanipulation and discussion of the termeasures of biomanipulation application in waters [J]. Journal of Lake Sciences, 2010, 22(3): 307—314 [刘恩生. 生物操纵与非经典生物操纵的应用分析及对策探讨. 湖泊科学, 2010, 22(3): 307—314]
[6] Liu J K. Ecological Research on East Lake (I) [M]. Beijing: Science Press. 1990, 292—371 [刘健康主编. 东湖生态学研究(一). 北京: 科学出版社. 1990, 292—371]
[7] Liu J K. Ecological research on East Lake (II) [M]. Beijing: Science Press. 1995, 360—415 [刘健康主编. 东湖生态学研究(二). 北京: 科学出版社. 1995, 360—415]
[8] Xie P. Silver Carp and Bighead with Algae Blooms Control [M]. Beijing: Science Press. 2003, 116 [谢平. 鲢、鳙与藻类水华控制. 北京: 科学出版社. 2003,116]
[9] Liu J K, Xie P. Direct control of Microcystis bloom through the use of planktivorous carp-closure experiments and lake fishery practice [J]. Ecologic Science, 2003, 22(3): 193—196 [刘建康, 谢平. 用鲢鳙直接控制微囊藻水华的围隔试验和湖泊实践. 生态科学, 2003, 22(3): 193—196]
[10] Li C Y, Cui Y. The application of biomanipulation in preventing and curing the eutrophication of cultivated water [J]. Marne Fisheries Research, 2002, 23(1): 71—75 [李春雁,崔毅. 生物操纵法对养殖水体富营养化防治的探讨. 海洋水产研究, 2002, 23(1): 71—75]
[11] Chen L S, Hong R H, He G X. The application of non-traditional biomanipulation in controlling the blooms [J]. Fishery Modernization, 2006, 3: 45—46 [陈来生, 洪荣华,何光喜. 运用非经典生物操纵技术治理水华. 渔业现代化, 2006, 3: 45—46]
[12] Li Q, Li D S, Xiong B X, et al. Influence of silver carp (Hypophthalmicthys molitrix C et V) on plankton community in reservoir enclosures [J]. Acta Ecologica Sinica, 1993, 13: 30—37 [李琪, 李德尚, 熊邦喜, 等. 放养鲢鱼(Hypophthalmicthys molitrix C et V) 对水库围隔浮游生物群落的影响. 生态学报, 1993, 13: 30—37]
[13] Gu X H, Liu G Y. Impact of sliver carp and bighead carp in fish ponds on plankton [J]. Journal of Ecology and Rural Environment, 1996, 12(1): 6—10, 41 [谷孝鸿, 刘桂英. 滤食性鲢鳙鱼对池塘浮游生物的影响. 农村生态环境, 1996, 12(1): 6—10, 41]
[14] Yan Y H, Zhong C H, Deng C G. Progress of non-traditional bio-manipulation in the controlling of eutrophication [J]. Journal of Anhui Agricultural Sciences, 2007, 35(12): 3459—3460 [闫玉华, 钟成华, 邓春光. 非经典生物操纵修复富营养化的研究进展. 安徽农业科学, 2007, 35(12): 3459—3460
[15] Domizon I, Devaux J. Impact of moderate silver carp biomass gradient on zooplankton communities in a eutrophic reservoir. Consequences for the use of silver carp in biomanipulatin [J]. Academie Des Sciences Paris Comptes Rendus Serie Generale La Vie Des Sciences, 1999, 322(7): 621—628
[16] Kajak Z, Rybak J L. Influence of the planktonivorous fish, Hypoph-thalmichthys molitrix, on the plankton and benihos of eutrophic lake Poi. Arch [J]. Archiv Fur Hydrobiologie, 1975, 22: 301—310
[17] Shi W L, Jin W H, Wang D Q. Effect of stocking of sliver carp and bighead carp on the eutrophication in waters [J]. Journal of Dalian Fisheries College, 1989, 4(3): 11—24 [史为良, 金文洪, 王东强. 放养鲢鳙对水体富营养化的影响.大连水产学院学报,1989, 4(3): 11—24]
[18] Lu K H, Jin C H, Dong S L, et al. Feeding and control of blue-green algal blooms by tilapia (Oreochromis niloticus) [J]. Hydrobiologica, 2006, 568: 111—120
[19] Lang Y P, Zhu L, Liu C G, et al. Bio- control of silver carp on phytoplankton in freshwater [J]. Journal of Agro-Environment Science, 2006, 25(Supplement): 683—686 [郎宇鹏, 朱琳, 刘春光, 等. 鲢鱼对淡水浮游植物的抑制作用研究.农业环境科学学报, 2006, 25(增刊): 683—686]
[20] He Z H, Li Y H. On the food of the silver carp [J]. Acta Hydrobiologica Sinica, 1975, 5(4): 541—548 [何志辉, 李永函. 论白鲢的食物问题. 水生生物学报, 1975, 5(4): 541—548]
[21] Lin D S, Jiang Y Z. On the food of the silver carp and bighead [J]. Current Zoology, 1954, 6(1): 59—71 [倪达书,蒋燮治. 花鲢和白鲢的食料问题. 动物学报, 1954, 6(1): 59—71]
[22] Zhou J, Lin F. The feeding habit of silver carp and bighead and their digestion of algae [J]. Acta Hydrobiologica Sinica, 1990, 14(2): 170—177 [周洁, 林峰. 鲢、鳙的食性及其对藻类的消化利用. 水生生物学报, 1990, 14(2): 170—177]
[23] Liu X J, Xie P, Wang S M, et al. Studies on the causes of resumption and disappearance of Microcystis bloom in donghu lake: stocking experiments in enclosures [J]. Journal of Lake Sciences, 1994, 6(3): 245—256 [刘学君, 谢平, 王少梅, 等. 武汉东湖微囊藻水华形成及消失原因的探讨一围圈放养实验. 湖泊科学, 1994, 6(3): 245—256]
[24] Wang H Z, Liu Y D, Xiao B D, et al. Ecological meaning and bloom controlling of different density of silver carp followed with potamogeton crispus in enclosures [J]. Acta Hydrobiologica Sinica, 2004, 28(2): 141—147 [王海珍, 刘永定, 肖邦定, 等. 围隔中鳞鲢和菹草控藻效果及其生态学意义. 水生生物学报, 2004, 28(2): 141—147]
[25] Stewart T W, Winer J G, Lowe R L. An experimental analysis of crayfish (Orconectes rustieus) effeets on a Dreissena dominated benthic macroinvertebrate community in western lake Erie [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1998, 55(4): 1040—1050
[26] Chen S L, Liu X F, Hua L. The role of silver carp and bighead in the cycling of nitrogen a nd phosphorus in the east lake ecosystem [J]. Acta Hydrobiologica Sinica, 1991, 15(1): 8—26 [陈少莲, 刘肖芳, 华俐. 鲢、鳙在东湖生态系统的氮、磷循环中的作用. 水生生物学报, 1991, 15(1): 8—26]
[27] Reinertsen H. Effcet of fish removal on to the limonitic ecosystem of an eutrophic lake [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1990, 47: 166—173
[28] Shapiro J, Wright D I. Lake restoration by biomanipulation: Round Lake, Minnesota, the first two years [J]. Freshwater Biology, 1984, 14: 371—383
[29] Pogozhev P I, Gerasimova T N. The effect of zooplankton on microalgae blooming and water eutrophication [J]. Water Resources, 2001, 7/8: 420—427
[30] Kharitonova N N, Sirenko L A, Stetsenko L I. Viability of planktonic algae passed intestines of herbivorous fish (case of bighead) [J]. Rybnoie khoziaistvo, 1987, 41: 1—80
[31] Kolmakov V I, Gladyshev M I. Growth and potential photosynthesis of cyanobacteria are stimulated by viable gut passage in crucian carp [J]. Aquatic Ecology, 2003, 37: 237—242
[32] Wang Y P, Zhao Y, Zeng Q F, et al. Changes in the photosynthetic activity of Microcystis colonies after gut passage through omnivorous fish [J]. China Environmental Science, 2013, 33(3): 524—529 [王银平, 赵勇, 曾庆飞,等. 杂食性鱼类排泄物中藻类光能活性研究. 中国环境科学, 2013, 33(3): 524—529]
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

