论文:投饲率对草鱼生长、体组成和能量收支的影响
投饲率对草鱼生长、体组成和能量收支的影响
许艳,罗伟,王春芳
(华中农业大学水产学院,池塘健康养殖湖北省工程实验室,淡水水产健康养殖湖北省协同创新中心,武汉430070)
为了建立草鱼(Ctenopharyngodonidella)的精准投喂模型管理系统,研究了不同投喂水平下草鱼的能量收支。实验在水温(27.5±2.0)℃条件下,选用初始体重(71.03±1.13)g的草鱼,共设5个不同投饲水平(饥饿、1% 鱼体重(1% BW)、2% BW、4% BW和饱食),研究摄食水平对草鱼生长、鱼体组分和能量收支的影响。结果显示:随投喂水平的增加,草鱼鱼体水分减少,粗蛋白含量、粗脂肪含量和能量增加,灰分含量先减少后增加。特定生长率和热积温生长系数均随投喂水平的增加先增加再降低,在5%鱼体重时达到最大,且高于饱食投喂组。饵料转化率(FE)在投喂水平为体重2%组最高,且显著高于其他各组。干物质和能量表观消化率随投喂水平的增加而显著增加,蛋白质表观消化率在投喂水平为体重2%组显著高于其他组。生长能比例随投喂水平的增加而显著增加,而在体重2%组到饱食组间均无显著性差异;代谢能与生长能相反。在最大投喂水平下的能量收支方程为:100 C=21.72 F+4.25 U+45.85R+28.18 G或100 A=61.94R+38.06G。结果表明,5%鱼体重的投喂量为草鱼此阶段的最佳投喂水平。
草鱼(Ctenopharyngodonidella);生长;体组成;能量收支
摄食水平是影响鱼类生长和能量收支的重要因素之一[1],是建立精准投喂系统的一部分。不同鱼类的生长-摄食关系有差别,多数鱼类为减速增长曲线上升关系[1-2],部分鱼类是简单的线性关系[3-4],若研究对象的生长-摄食关系呈线性关系,其饱食水平时的特定生长率和饲料转化率都最高,其最佳投喂水平即为饱食水平;若呈减速增长曲线关系,其饲料转化率随摄食水平的增加先增加后降低,其最大值很难与最大摄食率出现在同一摄食水平处,其最佳投喂水平为低于饱食水平的某处。
目前,摄食水平对鱼类生长和能量收支的影响已有一些报道,如异育银鲫(Carassiusauratusgibelio)[5]、梭鱼(Lizahaematocheila)[6]、黄颡鱼(Pelteobagrusfulvidraco)[7]等,但这些研究都集中于初始体重为1~5 g的幼鱼阶段。处于不同生长阶段的鱼类的生长速度不同,对能量的分配比例也有一定的差异。有关草鱼生物能量学方面的研究主要是12~13 g的幼鱼阶段的草鱼,且研究期间投喂的饵料是莴苣叶[8-11]。为了建立一套满足草鱼整个生长阶段的精准投喂模型,有必要了解草鱼在不同发育阶段的生长和摄食特点。本实验以配合饲料为饵料,研究大规格草鱼(71.03±1.13 g)在不同投喂水平下的生长、体组成及能量分配情况,以期了解此阶段的草鱼在不同摄食强度下的生物能量学特征,为建立草鱼精准投喂模型提供基础,为草鱼的科学养殖管理提供理论依据。
1 材料与方法
1.1实验材料
实验用草鱼(Ctenopharyngodonidellus)于2014年8月采购自湖北省黄冈市红安县渔场的当年鱼种,初始体重为(71.03±1.13)g,实验鱼购回后,在华中农业大学南湖基地循环水养殖系统中暂养,并在实验条件下驯化至可以适应实验室养殖环境。
实验饲料为粗蛋白含量33.78%的配合饲料,添加0.1%的三氧化二钇(Y2O3)作为测定消化率的指示剂。实验饲料按配方混合后经颗粒饲料机制成直径为0.3 cm,长度为1~1.5 cm的颗粒,并于4℃冰箱保存。饲料配方及营养成分组成见表1。
1.2试验方法
实验设计了饥饿、1% 鱼体重(1% BW)、2% BW、4% BW和饱食5个投喂水平,每个实验水平设计3个平行,每个平行8尾鱼。实验缸随机分配于不同投喂水平处理,实验温度为(27.5±2.0)℃。实验期间,每天定时定量投喂,即每天9:00和15:00按设定的投喂水平定量投喂,饱食组投喂过量的饲料,1 h后回收残饵,70 ℃烘干后称重,并计算残饵回收率以校准投喂量。喂食2 h后,用虹吸法移出粪便,70 ℃烘干备用。
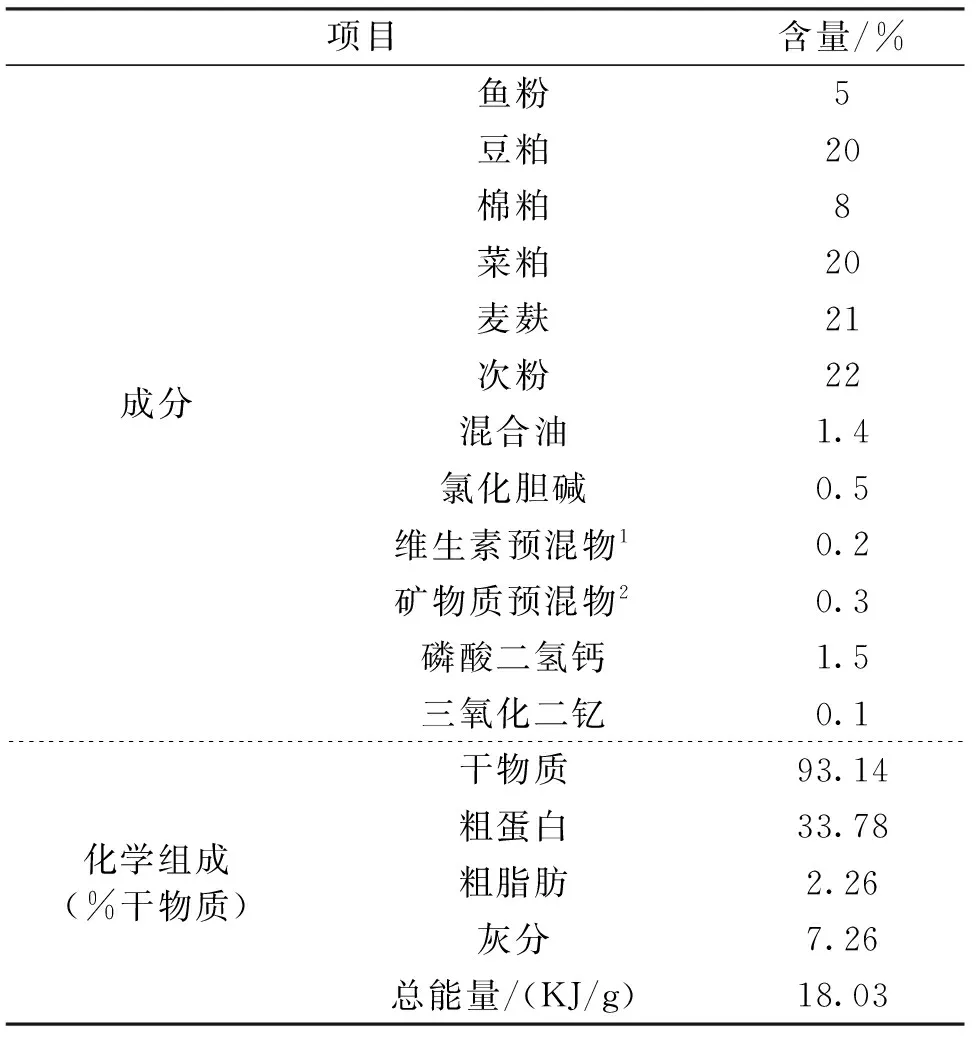
表1 实验饲料配方及化学成分Tab.1 Formulation and chemical composition of the experimental diets
注:1.维生素预混物可为每千克饲料提供:维生素A 5 500 IU,维生素D31 200 IU,维生素E 40 mg,维生素K31.5 mg,维生素B13 mg,维生素B23.5 mg,维生素B63.5 mg,维生素B120.02 mg,维生素C 75 mg,烟酸20 mg,泛酸钙20 mg,叶酸1mg。
2.矿物质预混物可为每千克饲料提供:硫酸亚铁75 mg,氯化铜2 mg,硫酸锌30 mg,硫酸锰10 mg,碘化钾0.3 mg,硒0.1 mg。
实验开始前,实验鱼先饥饿48 h,以排空体内粪便,然后称重(初始体重为71.03 g±1.13 g)。同时随机取6尾鱼作为对照,70 ℃烘干,用以估算实验开始时鱼体的干物质含量和能量含量。
实验持续56 d,实验结束时,实验鱼饥饿48 h后称重,并取样待分析。
1.3实验样品测定
生长实验结束后,测定鱼体和饲料的干物质、蛋白质、脂肪、灰分和能量含量,粪便的蛋白及能量含量,饲料和粪便Y2O3含量。干物质在105 ℃烘干至恒量测定;蛋白质的测定使用凯氏定氮法测定;脂肪采用乙醚索氏抽提法测定;灰分用马福炉在550 ℃下灼烧6 h以上至恒重测定;饲料和鱼体能量含量利用氧弹仪(Parr Instrument Company,Moline,IL,USA)测定;饲料和粪便Y2O3含量采用电感耦合等离子体发射光谱仪(ICP)测定。每个样品至少三个平行。
1.4计算公式
1.4.1摄食和生长指标计算公式:
增重率WG=100%×(Wt-Wo)/Wo
特定生长率SGR=100%×(lnWt-lnWo)/t
饵料转化效率FE=100%×(Wt-Wo)/FI
上述公式中Wt(g)和Wo(g)分别是鱼体终末和初始湿重,T(℃)为实验期间的平均水温,FI(g)为平均每尾鱼摄入饲料量,t(d)为实验实际摄食天数。
1.4.2消化率指标计算公式:
干物质表观消化率ADCd=100%×(1-Y1/Y2)
蛋白质表观消化率ADCp=100%×(1-Y1P2/Y2P1)
能量表观消化率ADCe=100%×(1-Y1E2/Y2E1)
上述公式中Y1(%)和Y2(%)分别是饲料和粪便中Y2O3的含量,P1(%)和P2(%)分别是饲料和粪便中的蛋白质含量,E1(kJ/g)和E2(kJ/g)分别是饲料和粪便中的能量含量。
1.4.3能量收支式:
C=F+R+U+G或A=R+G
C(kJ)=FI×CE
F(kJ)=C×(1-ADCe/100)
U(kJ)=[(NI-NF-NR)×17/14]×24.83
G(kJ)=Wt×CEt-Wo×CEo
R(kJ)=C-F-U-G
式中,C为食物能,根据摄入的饲料量和饲料能量含量计算;G为生长能,根据实验期间鱼体总能量变化计算;F为排粪能,根据表观消化率计算;U为排泄能,根据每缸的氮排泄量计算,按照24.83J/mg氨氮换算成能量;R为代谢能,根据食物能与能量收支其他组分之间的差值来计算;A为同化能,为生长能和代谢能的总和。CE(kJ/g)为饲料中能量含量;NI,NF和NR分别是食物氮、粪便氮和鱼体储存氮;CEt(kJ/g)和CEo(kJ/g)分别为终末和初始鱼平均能量含量。
1.5数据处理
数据整理使用Microsoft Excel 2003进行,使用SPSS软件进行数据的单因素方差分析(One-way ANOVA),并进行Duncan′s多重比较,以P<0.05作为显著性差异水平。
2 结果与分析
2.1投喂水平对草鱼鱼体生化组成及能量含量的影响
草鱼鱼体水分、粗蛋白、粗脂肪、灰分及能量含量的结果见表2。结果表明,随投喂水平的增加,草鱼鱼体的水分含量显著降低,但第3组和第5组都与第4组无显著性差异;粗蛋白含量随投喂水平的增加显著增加,但第3组、第4组和第5组间没有显著性差异;粗脂肪和能量含量随投喂水平的增加而显著增加,而饱食组显著高于其他组;第2组、第3组和第4组间的灰分含量无显著性差异,但显著低于第1组和第5组。

表2 投喂水平对草鱼鱼体生化组成及能量含量的影响Tab.2 Effects of different ration levels on body composition and energy content of grass carp
注:同一行数值(平均值±标准误)上方的字母不同表示有显著性差异(P<0.05),下同。
2.2投喂水平对草鱼生长和饲料转化率的影响
表3表示,随投喂水平的增加,草鱼增重率、特定生长率(SGR)和热积温生长系数(TGC)都显著性增加;饵料效率先增加再降低,在体重2%组显著高于其他各组,体重4%组和饱食组无差异显著性。

表3 投喂水平对草鱼生长的影响Tab.3 Effects of different ration levels on growth of grass carp
由图1可知,随投喂水平的增加,草鱼特定生长率(SGR)先增加后降低,其摄食-生长关系可用二次函数表示,从该模型上可以看出其特定生长率在投喂水平为体重5%时达到最大。图2表示,草鱼的热积温生长系数(TGC)与投喂水平的关系,与特定生长率随投喂水平的变化趋势一致,呈二次函数关系,模型显示,也是在体重5%投喂水平处热积温生长系数达到最大值。

图1 草鱼特定生长率SGR与投喂水平的关系Fig.1 Relationship between SGR and ration level in the grass carp

图2 草鱼热积温生长系数TGC与投喂水平的关系Fig.2 Relationship between TGC and ration level in the grass carp
2.3投喂水平对草鱼表观消化率的影响
由表4可见,随投喂水平的增加,干物质和能量的表观消化率显著增加;体重2%组的蛋白质表观消化率显著高于其他组。

表4 投喂水平对草鱼表观消化率的影响Tab.4 Effects of different ration levels on apparent digestibility coefficients of grass carp
2.4投喂水平对草鱼能量收支的影响
不同投喂水平下的能量收支如表5所示,草鱼排粪能占食物能的比例随投喂水平的增加而显著减少,在饱食组达到最小值为21.72%;排泄能占食物能的比例在体重2%投喂水平组最低,为2.25%;生长能比例随投喂水平的增加而显著增加,但在体重2%组到饱食组间均无显著性差异;代谢能与生长能趋势正好相反。
当以占同化能的比例来表示能量收支时,代谢耗能随投喂水平的增加而显著降低,而在体重2%组到饱食组间均无显著性差异;用于生长的同化能与代谢耗能相反。
饱食水平下的能量收支式为:
100 C=21.72 F+4.25 U+45.85R+28.18 G
或100 A=61.94R+38.06G

表5 投喂水平对草鱼能量收支的影响Tab.5 Effects of different ration levels on energy budget of grass carp %
注:饥饿鱼的能量收支以KJ/d表示;同化能A=C-F-U。
3 讨论
3.1鱼体成分和能量含量
鱼体成分常被用来评价鱼肉品质,鱼体成分会受到一些因素的影响,比如生长、饵料、摄食等,也会受到摄食水平的影响。崔奕波[1]指出,随摄食水平的增加,鱼体的干物质、脂肪和能量含量增加;蛋白质含量变化无一致性结果;灰分含量减少;牙鲆(Paralichthysolivaceus)幼鱼的水分、粗脂肪、粗蛋白和灰分含量都不受摄食水平的影响[12];随着摄食水平的增加,黄颡鱼(Pelteobagrusfulvidraco)[13]鱼体中粗蛋白含量增加,而粗脂肪含量降低。本研究结果表明,鱼体中的水分随投喂水平的增加而显著降低;脂肪和能量含量随投喂水平的增加而显著增加,在饱食组最大;粗蛋白随投喂水平的增加而显著增加,但在投喂水平达到体重2%后增加不明显,与上述牙鲆、黄颡鱼的研究结果不一致,这可能与鱼种差异、鱼体规格、饵料类型等有关。本实验结果也说明了,当达到一定投喂水平(体重2%)后草鱼蛋白质含量增加不明显,主要表现出脂肪含量的显著增加,造成脂肪的积累。若以鱼体组分作为评价指标,最适投喂水平应该在体重2%到饱食之间。
3.2特定生长率、积温系数和饵料转化率
关于鱼类的摄食-生长关系的模型报道不一,但主要表现为两种类型:一种是减速增长曲线[14-15],另一种是线性关系[16-18]。对于某一种鱼类而言,其摄食—生长关系的确定是非常重要的。如果是直线模型,则其最大摄食水平即为最佳投喂水平;如果是减速增长曲线模型,其最佳投喂水平应该接近最大摄食水平[2]。Bureau等[19]对虹鳟(Onchorynchusmykiss)的各个生长模型进行预测的结果表明,虽然在目前的鱼类营养学研究中特定生长率(SGR)模型依然被广泛应用,但热积温生长系数(TGC)模型能够更加准确地预测鱼类的生长。当鱼体增大时,特定生长率(SGR)模型预测的生长与实际观测值出现严重偏差,高估了鱼体的生长。本研究得到的热积温生长系数与特定生长率的结果一致,草鱼特定生长率和热积温生长系数都随投喂水平的增加先增加后降低,在体重5%投喂水平处特定生长率达到最大,其摄食-生长关系为减速增长曲线关系。由本研究结果可知,若以特定生长率和热积温生长系数作为评价最佳投喂量的指标,则接近最大摄食水平(饱食)的5%鱼体重的投喂量即为草鱼此阶段的最佳摄食水平,既能保证草鱼的增长最快,又能减少养殖成本,还能避免因过量投饵造成的养殖环境污染等问题。
有些研究表明,饲料转化效率随摄食水平的增加而下降[20-21];然而有的研究也反映,饲料转化效率随摄食水平的增加而增加[6,22]。导致不同结论的原因可能是摄食水平的范围设置得不够宽或摄食水平未达到真正的最高水平。而多数鱼类的饵料转化率在中间摄食水平时最大[23-24]。本实验中,饵料转化率随投喂水平的增加先增加再降低,在投喂水平为体重2%时达到最大,与多数鱼类的趋势一致。
3.3表观消化率
不同研究对于投喂水平与表观消化率的关系结果不同。有些学者的研究表明,鲫(Carassiusaruatus)[25]、细鳞鲑(Brachymystaxlenok)[26]等的表观消化率不受摄食水平的影响;有些研究表明,尼罗罗非鱼(Orechromisniloticus)[27]、黄颡鱼(Pelteobagrusfulvidraco)[28]的表观消化率随摄食水平的增加而下降;也有学者认为表观消化率随摄食水平的增加而增加,如卵形鲳鲹(Trachintusovatus)[29]。这些研究结果不同可能与鱼种差异、鱼体发育阶段、实验方法及实验条件等不同有关。本实验中干物质和能量表观消化率随投喂水平的增加而显著增加,而蛋白质表观消化率在投喂水平为体重2%组最高,这是因为体重2%组的饵料转化率最高,体重2%的投喂水平使实验草鱼的摄食量不足,造成营养成分在数量上的缺乏,虽然有较高的转化率,但并不能完全补偿营养上的不足,所以特定生长率赶不上相对较高投喂水平组,但能表现出较高的表观消化率。
3.4能量收支
Brett等[30]总结了前人的数据结果,得出平均能量收支方程:
肉食性鱼类:100C=27(F+U)+44R+29G
植食性鱼类:100C=42(F+U)+37R+20G
之后,Cui等[31]总结了14种鱼类在最大摄食率下的能量收支,得到平均收支式为:
100C=15.7 (F+U)+51.5R+32.8G
或
100A=60R+40G
Cui等[11]测定30℃时摄食水平对草鱼生长和能量收支的影响,得到最大摄食水平下的能量收支式为:
100C=49.1F+4.5U+34.5R+11.9G
或
100A=74.4R+25.6G
本实验中,草鱼在最大投喂水平下的能量收支式为:
100C=21.72F+4.25U+45.85R+28.18G
或
100A=61.94R+38.06G
由此可知,本实验得到的草鱼的生长能比例比Cui等[11]的偏高,这一方面可能是因为Cui等[11]投喂的是莴苣叶,而本实验投喂的是配合饲料,饲料不同导致生长能量分布不同;另一方面可能与鱼体质量有关,Cui等[11]的实验草鱼只有12~13g,本实验中的草鱼是(71.03±1.13)g,而体质量又是影响能量收支的重要因素之一[10]。与Cui等[31]总结的14种鱼类得到的平均值相比,本实验草鱼生长能占食物能和同化能的比值偏低,用于代谢的能量比值偏高,出现这种结果是因为草鱼属植食性鱼类,与其他鱼类相比生长效率较低,代谢耗能较高。本实验研究结果与牙鲆(Paralichthysolivaceus)[12]、异育银鲫(Carassiusauratusgibelio)[5]及青石斑鱼(Epinephelusawoara)[32]结果一致,而与褐牙鲆(Paralichthysolicaceus)[33]、长吻鮠(leiocassislongirostrisGünther)[34]和军曹鱼(Rachycentroncanadum)[35]不同。鱼类能量收支方程存在差异的可能原因有:(1)温度、鱼体规格、饵料种类、投喂频率、鱼体发育阶段及摄食量等因素对能量收支模式的影响比较大;(2)能量计算方法不同,本研究中代谢能的计算是根据能量收支差值得到的,包含了能量收支式中所有组分的误差,同时,部分粪便溶失造成粪便收集不全,造成粪便氮含量(NF)减少,由计算公式可知排泄能相对增加,从而使代谢能比实际值偏低;(3)实验鱼的食性,Cui等[31]总结出肉食性鱼类、植食性鱼类的平均能量收支方程式存在很大差异,需要根据不同种类来研究不同养殖条件下的能量收支。
4 结论
(1)随投喂水平的增加,草鱼特定生长率(SGR)和积温系数(TGC)先增加后降低,在5%鱼体重时达到最大,高于饱食组;饲料转化率在2%鱼体重时最大。
(2)随投喂水平的增加,脂肪和能量含量显著增加,在饱食组最大;而粗蛋白随投喂水平的增加显著增加,但在投喂水平为体重2%到饱食之间没有显著性差异,说明当达到一定摄食水平时,草鱼蛋白质含量增加不明显,主要表现出脂肪含量的增加,即主要以脂肪的形式存储过剩的营养物质。
(3)生长能比例随投喂水平的增加而显著增加(P<0.05),在体重2%组到饱食组间均无显著性差异(P>0.05);代谢能与生长能相反。
(4)草鱼在最大投喂水平下的能量收支式为:100C=21.72F+4.25U+45.85R+28.18G或100A=61.94R+38.06G,说明草鱼与其他鱼类相比生长效率较低,代谢耗能较高,与草鱼植食性的食性相吻合。
综合特定生长率和热积温生长系数两个指标,以及草鱼的生长能比例在2%鱼体重到饱食之间差异不显著(P>0.05)可得知,5%鱼体重的投喂量是草鱼现阶段的最佳投喂水平。
[1]崔奕波.鱼类生物能量学的理论与方法[J].水生生物学报,1989,13(4):369-383.
[2]韩冬.长吻鮠投喂管理和污染评估动态模型的研究[D].武汉:中国科学院水生生物研究所,2005.
[3]线薇薇,朱鑫华.摄食水平对褐牙鲆幼鱼生长影响的初步研究[J].青岛海洋大学学报,2000,30(3):453-458.
[4]Sun L H,Chen H R,Huang L M,et al.Growth,faecal production,nitrogenous excretion and energy budget of juvenile yellow grouper(Epinephelusawoara) relative to ration level[J].Aquaculture,2006,259(1):211-221.
[5]朱晓鸣,解绶启,崔奕波.摄食水平对异育银鲫生长及能量收支的影响[J].海洋与湖沼,2000,31(5):271-279.
[6]线薇薇,朱鑫华.摄食水平对梭鱼的生长和能量收支的影响[J].海洋与湖沼,2001,32(6):612-619.
[7]张磊.黄颡鱼能量收支及生物能量学最适生长模型的研究[D].武汉:华中农业大学,2010.
[8]Cui Y,Liu X,Wang S,et al.Growth and energy budget of young grass carp,CtenopharyngodonidellaVal.,fed plant and animal diets[J].Fish Biol,1992,41(2):231-238.
[9]崔奕波,陈少莲,王少梅.温度对草鱼能量收支的影响[J].海洋与湖沼,1995,26(2):169-174.
[10]崔奕波,陈少莲,王少梅.体重对草鱼幼鱼生长及能量收支的影响[J].水生生物学报,1996,20(增刊):172-177.
[11]Cui Y,Chen S,Wang S.Effect of ration size on the growth and energy budget of the grass carp,Ctenopharyngodonidellaval[J].Aquaculture,1994,123(1):95-107.
[12]陈晶,吴立新,吴玉波,等.不同摄食水平对牙鲆幼鱼生长及能量收支的影响[J].水产科学,2012,31(1):1-6.
[13]王吉桥,王凯,王声权,等.不同摄食率对黄颡鱼幼鱼生长和存活的影响[J].水产学杂志,2005,18(2):1-5.
[14]雷思佳,叶世洲,胡先勤.摄食水平对中华鳖稚鳖生长、氮排泄和能量收支的影响[J].水生生物学报,2005,29(1):43-49.
[15]孙丽华,陈浩如,黄洪辉,等.摄食水平和饵料种类对军曹鱼幼鱼生长及氮收支的影响[J].热带海洋学报,2010,29(4):94-101.
[16]Cui Y,Hung S S O,Zhu X.Effect of ration and body size on the energy budget of juvenile white sturgeon[J].Fish Biol,1996,49(5):863-876.
[17]刘姚,王永军,田秀娥,等.摄食水平对泥鳅生长、饲料利用率和体成分的影响[J].饲料工业,2011,32(12):26-28.
[18]杨严鸥,姚峰,郑建忠,等.摄食水平对黄颡鱼生长和饲料利用效率的影响[J].饲料工业,2006,27(12):30-32.
[19]Bureau D P,Azevedo P A,Tapia-Salazar M,et al.Pattern and cost of growth and nutrient deposition in fish and shrimp:potential implications and applications[C]//Cruz-Suarez L E,Ricque-Marie D,Tapia-Salazar M,et al.Avances in Nutrition in aquaculture.5.Proceedings of the 5thInternational Symposium on Nutrition in Aquaculture.Nuevo leon,Mexico,2000:111-140.
[20]Meyer-Burgdorff K H,Osman M F,Gunther K D.Energy metabolism inOreochromisniloticus[J].Aquaculture,1989,79(1-4):283-291.
[21]曾祥玲,林小涛,夏新建,等.摄食水平对食蚊鱼生长、卵巢发育和能量收支的影响[J].中国水产科学,2011,18(4):828-835.
[22]王乾.摄食水平和温度对翘嘴鳜幼鱼生长、排粪、排泄及氮收支影响的研究[D].武汉:华中农业大学,2013.
[23]张耀,张波,唐启升.摄食水平和饵料种类对黑鲪能量收支的影响[J].海洋水产研究,2001,22(2):32-37.
[24]Cho S H,Lee S M,Park P H,et al.Effect of feeding ration on growth and body composition of juvenile olive flounderParalichthysolivaceusfed extruded pellets during the summer season[J].Aquaculture,2006,251(1):78-84.
[25]罗琳,丁建中,薛梅,等.加工工艺、投喂率、投喂频率对鲫鱼生长性能及消化率的影响[J].渔业现代化,2007,34(5):43-46.
[26]Liu Y,Li Z J,Zhang T L,et al.Growth and energy budget of juvenile lenokBrachymystaxlenokin relation to ration level[J].Chin J Oceanol Limnol,2015,33(2):347-355.
[27]Xie S Q,Cui Y B,Yang Y X,et al.Energy budget of Nile tilapia(Oreochromisniloticus) in relation to ration size[J].Aquaculture,1997,154(1):57-68.
[28]方巍.黄颡鱼摄食和投喂策略的研究[D].武汉:华中农业大学,2010.
[29]黄建盛,陈刚,张建东,等.摄食水平对卵形鲳鲹幼鱼的生长和能量收支的影响[J].广东海洋大学学报,2010,30(1):18-31.
[30]Brett J R,Groves T D D.Physiological Energetics//Hoar W S,Randall D L,Brett J R.Fish Physiology,Vol.VIII.New York:Academic Press,1979,279-352.
[31]Cui Y,Liu J.Comparison of energy budget among six teleosts III.Growth rate and energy budget[J].Comp Biochem Physiol,1990,97(3):381-384.
[32]Sun L H,Chen H R,Huang L M.Growth,faecal production,nitrogenous excretion and energy budget of juvenile yellow grouper(Epinephelusawoara) relation to ration level[J].Aquaculture,2007,264(1-4):228-235.
[33]线薇薇,朱鑫华.摄食水平对褐牙鲆幼鱼能量收支的影响[J].青岛海洋大学学报,2001,31(5):695-700.
[34]Han D,Xie S Q,Lei W,et al.Effect of ration on the growth and energy budget of Chinese longsnout catfish,LeiocassislongirostrisGünther[J].Aquacult Res,2004,35(9):866-873.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊"!

