鲤春病毒血症病毒生物学研究进展
鲤春病毒血症病毒生物学研究进展
刘佳 卢玉婷 刘芸娜 闫子豪 汪惠庆 李月红
(吉林农业大学动物科学技术学院,吉林长春 130118)
鲤春病毒血症(Spring Viraemia of Carp,简称SVC)是由鲤春病毒血症病毒(Spring Viraemia of Carp Virus,简称SVCV)引起的1种急性、出血性疾病,该病毒属于弹状病毒科,其病毒粒子长80~180 nm,直径60~90 nm,鲤科鱼类易感染此病,其他科鱼类及两栖类也有感染此病毒的报道。SVC传染性强,发病率高,死亡率高,一旦暴发,养殖鱼死亡率可达90%以上[1-2]。鲤春病毒血症是世界动物卫生组织(OIE)必报的动物疫病。早在1992年我国就将其列为二类动物疫病,并收录进《中华人民共和国进境动物一、二类传染病、寄生虫病名录》,2008年又将其列为一类动物疫病。
SVC一旦暴发会严重影响水产养殖生产,并造成巨大的经济损失。因此,深入研究SVCV的致病机制对于鲤春病毒血症的防治具有重要意义。本文从SVCV的流行特点、传播方式、临床症状、生物学特征、基因组特征和蛋白结构特征等方面进行综述,旨在为该病的后续研究提供参考。
1 流行特点、传播方式和临床症状
1.1 流行特点
SVC分布地域较广,主要流行于欧洲和中东地区,目前有报道的国家包括奥地利、匈牙利、保加利亚、法国、德国、英国、意大利、西班牙以及捷克、斯洛伐克和俄罗斯的部分地区[2]。此外,1998年英国环境、渔业和水产养殖科学研究中心(The Centre for Environment, Fisheries and Aquaculture Science,简称CEFAS)从来自中国北京的金鱼和锦鲤中分离出病毒,并鉴定为SVCV[3]。1930年,SVC在欧洲首次发现,当时人们称该病为传染性水肿,但这一观点争议较大,仅被少数人接受。随后,1971年南斯拉夫的Fijan[4]在发生急性水肿的鱼体中分离出SVCV病毒,被世界公认为首次发现。SVCV宿主广泛,包括鲤、鲢、鳙和草鱼等经济鱼类,也包括锦鲤和斑马鱼等观赏鱼类,其中鲤科鱼类最为易感。SVCV通常在春季、水温为12~22 ℃时暴发,在寒冷的冬季后,水温开始回升,当水温升高到15~17 ℃时鱼的发病率及死亡率最高,尤其幼鱼最为明显。当水温高于17 ℃时,成鱼很少发病,但幼鱼在水温20~22 ℃时也会感染此病并有死亡。当温度升至22 ℃以上时,SVCV虽然可感染仔鱼,但不会造成养殖鱼类大规模发病,可能是由于水温较高时,鱼类机体代谢旺盛,免疫反应较为强烈[5]。据报道,该病对欧洲1龄鲤鱼的影响重大,据估计1龄鲤鱼的损失在10%~15%,相当于每年4 000 t左右[6]。
1.2 传播方式
SVCV传播方式包括水平传播和媒介传播,以水平传播为主。水平传播的主要传染源包括病鱼和死鱼等。媒介传播包括生物性媒介和非生物性媒介,生物性媒介主要包括水蛭和鱼虱等,非生物性媒介则主要为水[7]。在自然条件下,病毒可以通过鳃侵入鱼体内,在鳃上皮细胞中增殖,并且储存在痊愈的鱼体内,这种鱼即成为病毒携带者。SVCV可通过粪便、尿液、鳃和皮肤黏液等分泌物排出体外,可在水中保持感染活性4周以上,在4~10 ℃的泥浆中保持感染活性6周以上[8]。
1.3 临床症状
鱼类感染SVCV后主要表现为摄食减少,游动缓慢,不能对外界刺激及时做出反应,身体平衡能力下降,出现侧游现象,甚至只卧于池底,基本不游动。病鱼临床症状表现为:眼球突出,腹部膨胀,肛门红肿,皮肤、鳃、眼睛及内脏有出血点或出血斑,通常体色发黑、鳃丝苍白,肌肉因出血而呈红色,内脏水肿、有出血斑点,其中以鳔最为常见,脾脏肿大、粗糙变形,肝坏死;组织病理变化表现为:肝实质充血、多灶性坏死和脂肪变性,脾脏充血,网状内皮细胞明显增生,淋巴管扩张,内充满淋巴细胞、巨噬细胞和细胞碎片,胰腺发生多灶性坏死和非化脓性炎症,心肌变性。小肠绒毛萎缩,肾小管阻塞,空泡和透明样变[9-10]。
2 病毒特征
2.1 基因组特征
目前,GenBank中主要有16株SVCV全基因序列(截至2020年),其中11株来自中国(见表1),各基因间亲缘关系进化树见图1[11]。SVCV的基因组为线性、单股不分段的负链RNA,核苷酸数约为11 kb,包含5个开放阅读框,从3′端到5′端基因的排列顺序为:3′-N-P-M-G-L-5′,依次编码SVCV核蛋白(nucleoprotein,N)、磷蛋白(phosphoprotein,P)、基质蛋白(matrix protein,M)、糖蛋白(glycoprotein,G)和RNA聚合酶蛋白(RNA polymerase,L)(见图2)[12]。SVCV基因组中各个基因之间的连接区相对保守,均以2个核苷酸(C、T)为间隔,但G-L的连接以4个核苷酸(C、T、A、T)为间隔[13]。SVCV基因组的前导区有69个核苷酸,其中60~64位是N基因的转录起始信号AACAG,这在每个基因中是一致的,拖尾序列长49个核苷酸,含有L基因的转录终止信号TATG(A)7,其末端存在着与前导区反向互补的核苷酸序列,这是弹状病毒基因组的1个主要特征,也是不分段负链RNA病毒的共同特征[13]。
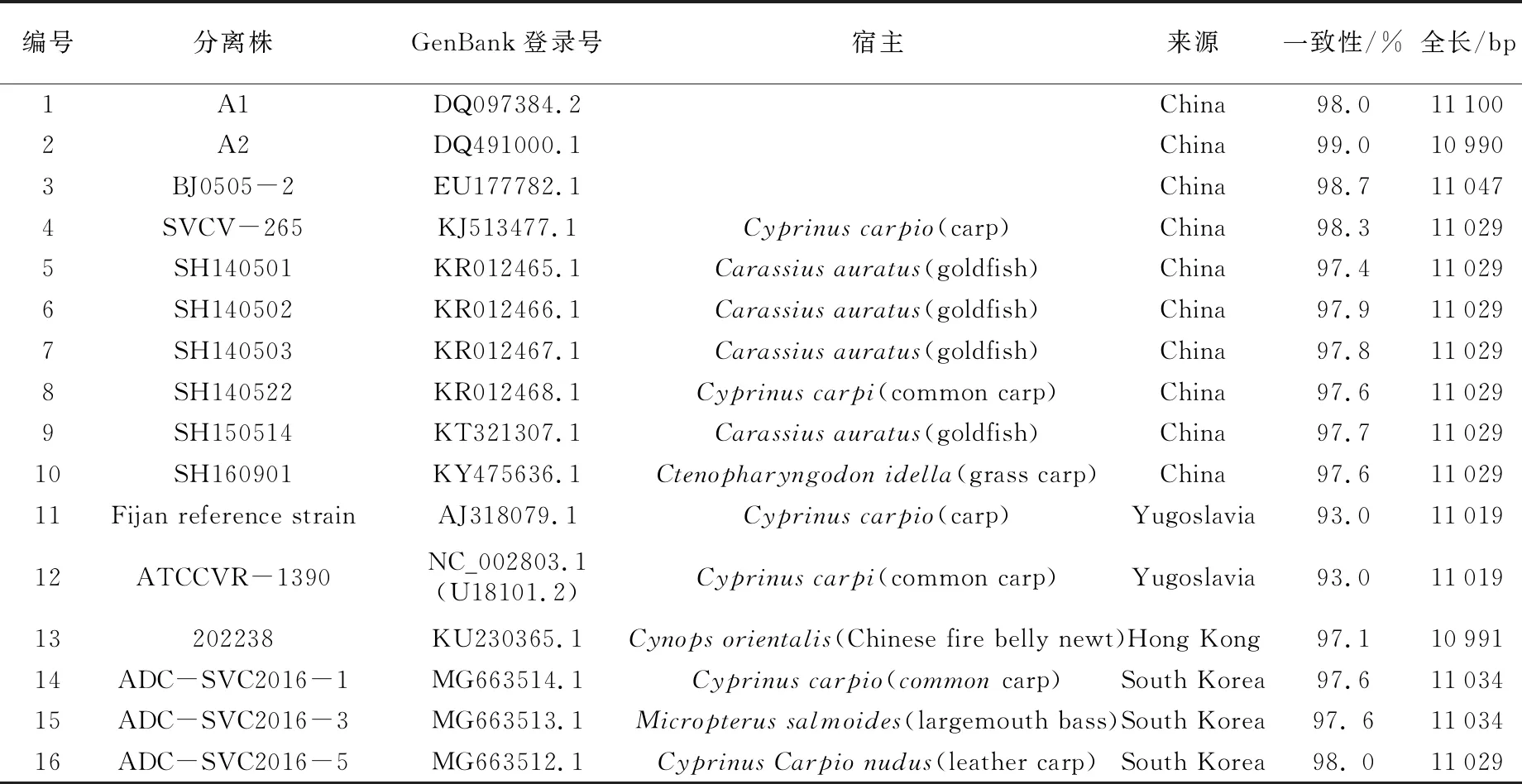
表1 GenBank中16株SVCV全基因序列表[11]

注:SVCV-shlj4于2020年10月刚提交至GenBank中,本文未对其进行统计。

(a)病毒结构模型;(b)基因组组织显示编码的蛋白质、基因连接以及前导区和尾区
2.2 结构蛋白特征
核蛋白N由418个氨基酸组成,是病毒双螺旋核衣壳的主要成分,相对保守,常用N基因作为靶标来检测SVCV,且准确检出率高。
磷蛋白P由309个氨基酸组成,磷蛋白P与核蛋白N和RNA聚合酶蛋白L蛋白结合形成核蛋白颗粒。核蛋白颗粒负责病毒的转录和复制。
基质蛋白M由223个氨基酸组成,M蛋白参与SVCV的组装和出芽。有研究报道,M蛋白可引起细胞凋亡,在细胞病理效应中起重要作用[14]。
糖蛋白G是病毒主要外膜蛋白之一,由509个氨基酸组成,位于病毒粒子表面,是病毒结构的关键组成部分。G蛋白与细胞受体结合并介导病毒内吞作用,帮助病毒侵入动物细胞,其构象变化将由内体酸化引发,使病毒基因组从核内体释放到细胞质中[15]。它携带中和抗原决定基,是DNA疫苗开发的潜在靶点。
根据G蛋白的基因序列,可进一步将SVCV分为Ia、Ib、Ic、Id等4个基因组[3]。Ia型病毒主要从英国、中国、美国和加拿大分离得到,Ib型和Ic型主要来自摩尔多瓦、乌克兰和俄罗斯等地分离的病毒株,Id型主要来自英国、德国和奥地利。SVCV进化聚类与地理分布密切相关,可能是不同地域病毒独立进化的结果。不同亚型的SVCV以不同的速度进化,Ia型被认为是最活跃的,有证据表明,Ia型的P基因和G基因的核苷酸突变率约为Id型的3.5倍,Ia型又进一步分为Iai和Iaii两个亚群。其中,从中国分离的4株SVCV分别为A1、A2、BJ0505-2和SVCV-265,经鉴定,SVCV-265为Iai亚群,A1、A2、BJ0505-2为Iaii亚群。全基因重组分析发现,A2、BJ0505-2株为A1株与SVCV-265同源重组后代,重组部位分别位于A2的3 845~6 387 bp和BJ0505-2的3 573~6 444 bp[16]。
RNA聚合酶蛋白L由2 095个氨基酸组成,是SVCV中最大的1个蛋白,因基因序列较长,存在一次性克隆难、多次克隆连接难等问题,目前对其功能性的研究相对较少。
3 检测技术
目前,SVCV血清学检测技术主要有病毒中和试验(NT)、免疫过氧化物酶试验(IP)、免疫荧光试验(IF)和酶联免疫吸附试验(ELISA)。然而,这些技术存在费时费力且SVCV抗血清的效价不高等问题[13]。SVCV和梭子幼鱼弹状病毒(Pike fry rhabdovirus,PFRV)具有共同的抗原决定簇,在IF和ELISA中发生交叉反应,两者很难区分[17]。PFR不是OIE必须申报的疫病。应用核糖核酸酶保护试验(RPA)可成功鉴别包括SVCV和PFR在内的13种具有交叉反应的硬骨鱼病毒。此外,RPA还揭示了不同品种鲤鱼和不同地点的SVCV分离株之间具有遗传多样性。近年来,也有应用噬菌体展示技术获得针对SVCV的抗体来检测病原,且该技术特异性强,无交叉反应,为SVCV的检测奠定了简单、经济的基础,有待于大范围推广使用。
SVCV的分子生物学检测技术主要基于PCR检测技术高灵敏度的优点,包括逆转录PCR、套式PCR、多重实时定量RT-qPCR、TaqMan实时定量PCR等。Oreshkova等[18-19]利用逆转录PCR(RT-PCR)构建了M基因和G基因生物素标记的DNA探针,用斑点杂交技术检测SVCV,该方法检出的样品病毒滴度TCID50达到105/g。高隆英等[20]报道了采用RT-PCR扩增G基因片段来检测SVCV,Koutna等[21]将RT-PCR与套式PCR技术相结合,能够快速可靠地检测到细胞培养和感染组织匀浆里的SVCV。PCR检测技术虽然特异性强、灵敏度高,但需要专门的仪器、熟练的操作手法以及无该病原污染的环境等,这些条件制约了该技术的应用[22]。
与嵌套式RT-PCR技术相比,RT-LAMP技术具有更高的特异性和敏感性,具有所需设备简单廉价、可以在养殖场轻松操作等优势,已成功应用于水产养殖病害防治。此外,该技术引入了纳米生物检测方法,在特定条件下,单链或双链寡核苷酸可与金纳米粒子在胶体溶液中杂交。Saleh等[23]利用这种特异性杂交分析方法直接检测临床样本中的SVCV,而无须扩增病毒RNA,该方法的特异性达100%,且不需要热循环仪器,测试时间也更短(15 min)。
4 疫苗的研究
疫苗的研制开发是控制疫病暴发的有效策略,然而,目前尚未有能有效预防SVCV感染的疫苗。限制此种类疫苗开发的问题是灭活疫苗保护率低、减毒疫苗对病毒减毒不当等。DNA疫苗作为1种能够有效替代传统疫苗的疫苗而受到广泛关注。但SVCV的DNA疫苗保护效果不理想,明显低于其他弹状病毒科疫苗。Kanellos等[24]根据SVCV的G蛋白设计了10种DNA疫苗,其保护率仅为11%~33%;而使用表达全长G基因的二联疫苗时,其保护率提高到48%。由于鱼的黏膜组织对抵御病原体入侵有重要的作用,黏膜免疫的激活可以防止病原体感染,这是注射疫苗无法达到的,因此,口服疫苗的研发成为新的研究方向。有研究显示,1种转基因植物乳酸菌共表达SVCV-G蛋白和锦鲤疱疹病毒ORF81蛋白对鲤鱼和锦鲤免疫65 d后的有效保护率分别为71%和53%[25],被免疫鲤鱼的免疫球蛋白M表达明显升高。这些结果表明,口服疫苗具有良好的免疫效果,且免疫过程简单,避免了注射疫苗时的机械损伤,有望在日后的研究优化后成为商业化疫苗。
5 展望
集约化水产养殖迅速发展的今天,如何将产出最大化是我们一直追求的目标。面对SVCV对水产养殖业带来的巨大经济损失,如何有效治疗SVC仍然是水产养殖亟需解决的难题之一。当前,针对SVCV的防控主要采取消灭传染源、切断传播途径及保护易感鱼群等方法措施,并没有高效的防控方法,加强检疫和免疫防控仍是防控SVC的主要手段,因此,需进一步优化鲤养殖环境因子、营养指数、群体行为特性的各技术环节,智能化监测鲤健康养殖过程中的各类参数,动态调整鲤预防技术指标[26]。此外,治疗药物及商业化疫苗的开发和研制具有很大的发展前景。目前,对SVCV基因组序列、蛋白组成和病毒结构的研究已比较明晰,但其致病途径和机理尚需进一步深入研究。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊"!

